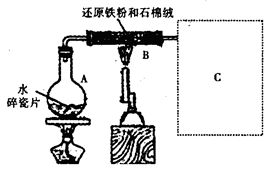
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
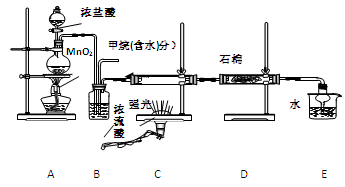
(1) B装置有三种功能:①控制气流速度;②均匀混合气体;③
|
(2) 设V(Cl2)/V(CH4)=x,若理论上欲取代反应获得最多的氯化氢则x≥
(3) D装置的石棉中均匀混有KI粉末其作用是 。(4) 在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
(5) E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 。
A.分液法 B.蒸馏法 C.萃取分液法 D.结晶法
(6)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为 (填编号)
A、CH4 B、CH3Cl C、CH2Cl2 D、CHCl3




 粤公网安备 44130202000953号
粤公网安备 44130202000953号