(1)常温下将0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①0.2mol/LHCl溶液中由水电离出的c(H+)__________0.2mol/LMOH溶液中由水电离出的c(H+); (填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_________mol/L。
(2)常温下若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的pH>7,则说明在相同条件下MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,则混合溶液的pH_______。(填“>7”、“<7”、或“无法确定”)
(4)用0.1032mol/LHCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示:
| 实验序号 |
0.1032mol/LHCl溶液体积/mL |
待测NaOH溶液体积/mL |
| 1 |
27.83 |
25.00 |
| 2 |
25.53 |
25.00 |
| 3 |
27.85 |
25.00 |
①待测NaOH溶液的物质的量浓度为_________mol/L。(保留四位有效数字)。
②下列情况可能引起测定结果偏高的是__________。
A.锥形瓶未用待测液润洗
B.酸式滴定管未用标准盐酸溶液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
| 化学式 |
AgCl |
AgBr |
AgI |
Ag2S |
Ag2CrO4 |
| 颜色 |
白色 |
浅黄色 |
黄色 |
黑色 |
红色 |
| Ksp |
1.8×10-10 |
5.0×10-13 |
8.3×10-17 |
2.0×10-48 |
1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的_________。
A.KI B.K2CrO4 C.KBr D.K2S
(12分)某科研小组在900℃的空气中合成出化学式为La2Ca2MnOx的超导体材料,其中La以+3价存在。为确定x的值,进行如下分析:
步骤1:准确称取0.5250g超导体材料样品,放入锥形瓶中,加25.00mL0.06000mol•L-1Na2C2O4溶液(过量)和25mL6mol•L-1HNO3溶液,在60-70℃下充分摇动,约半小时后得到无色透明溶液A(该条件下,只有Mn元素被还原为Mn2+,Na2C2O4被氧化为CO2)。
步骤2:用0.02000mol•L-1KMnO4溶液滴定溶液A至终点,消耗10.00mL KMnO4溶液。
(1)步骤1反应后溶液中Mn2+的物质的量浓度为0.02000mol•L-1。常温下,为防止Mn2+形成Mn(OH)2沉淀,溶液的pH的范围为 [已知Mn(OH)2的Ksp=2.0×10-13]
(2)步骤2滴定终点的现象是 。
(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则所测x的值将 (填“偏大”、“偏小”或“不变”)。
(4)求x的值(写出计算过程)。
(1)①pH= a的CH3COOH溶液稀释100倍后所得溶液pH a +2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH 2(填“>”或“<”);
③0.1mol/LCH3COONa溶液的pH 7(填“>”或“<”);
(2)某固体是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3和(NH4)2SO4中的两种混合而成。取该固体溶于水得到无色澄清溶液,向该溶液中加入稀硫酸,有白色沉淀生成,继续加入稀硫酸,沉淀又完全消失,且整个过程中无气体产生。则 原固体中含有物质有 和 。(写化学式)
(16分)现有浓度均为0.1 mol·L-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________________________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是__________________________。
(3)已知T ℃,KW=1×10-13,则T ℃________25 ℃(填“>”、“<”或“=”)。在T ℃时将pH=11的NaOH溶液a L与pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=________。
(4)25 ℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=________(填数据);
②若x+y=13,则a/b=________(填数据);
③若x+y>14,则a/b=________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为________(填表达式)。
草酸(H2C2O4)是二元弱酸,25℃时,H2C2O4:K1=5.4×10-2,K2=5.4×10-5;H2CO3:K1=4.5×10-7,K2=4.7×10-11。
(1)KHC2O4溶液呈__________性(填“酸”、“中”或“碱”)。
(2)下列化学方程式可能正确的是 。
A.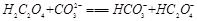 |
B.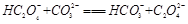 |
C.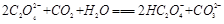 |
D.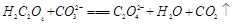 |
(3)常温下,向10 mL 0.01 mol·L-1H2C2O4溶液中滴加0.01 mol·L-1的KOH溶液V mL,回答下列问题:
①当V<10时,反应的离子方程式为______________________________________________。
②若溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-),则pH______7(填“>”“<”或“=”),V________10(填“>”“<”或“=”)。
③当溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),则溶液中溶质为____________,V________10(填“>”、“<”或“=”)。
④当V=20时,溶液中HC2O4-、C2O42-、H2C2O4、OH-的物质的量浓度从大到小的顺序为____________________________________________________________________________________。
下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t1 |
t2 |
| Kw/ mol2·L-2 |
1×10-14 |
a |
1×10-12 |
试回答以下几个问题:
(1)若25< t1< t2,则a 1×10-14(填“<”、“>”或“=”),由此判断的理由是: 。
(2)在t1℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为: 。
(3)在t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的硫酸溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 = ,此溶液中各种离子的浓度由大到小的顺序是 。
有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
| 阳离子 |
Na+、Ba2+、NH4+ |
阴离子 |
CO32-、Cl-、OH-、SO42- |
①A、C溶液的pH均大于7,A、B的溶液中水的电离程度比纯水大,A、D焰色反应的火焰均为黄色;
②C溶液和D溶液相遇时只观察到有白色沉淀产生,B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,A溶液和D溶液混合时无明显现象。请填写下列空白:
(1)A是___________,B是___________,C是____________,D是___________。
(2)常温,将1 ml pH =12的C溶液加水稀释至100ml,所得溶液中 = ;
= ;
(3)常温下,0.15 mol·L-1的C溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13,则C溶液与盐酸的体积比= _______________。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 。
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH 11(填“>”“=”或“<”),原因是 (用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为 ;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 性,溶液中c(Na+) c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈 性,溶液中c(Na+)
c(CH3COO-)(填“>”“=”或“<”);
(4)25℃,用0.1000 mol / LNaOH溶液滴定20.00mL0.1000mol/L某一元酸HA溶液所得滴定曲线如图。
①为减小实验误差,由图可知滴定时指示剂应选用 (填“石蕊”、“酚酞”、“甲基橙”);
②A、B、C三点所示溶液导电能力最强的是 点对应的溶液;
③25OC,HA的电离平衡常数约为 。
下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t1 |
t2 |
| Kw/ mol2·L-2 |
1×10-14 |
a |
1×10-12 |
试回答以下几个问题:
(1)若25< t1< t2,则a 1×10-14(填“<”、“>”或“=”),由此判断的理由是:
。
(2)在t1℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为: 。
(3)在t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的硫酸溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 = ,此溶液中各种离子的浓度由大到小的顺序是 。
(1) 25℃时,部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡常数 |
Ki=1.7×10-4 |
Ki=4.9×10-10 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
①HCOONa溶液呈 性(填“酸”、“碱”或“中”),其原因是
(用离子方程式表示)。
②在测定c(H+)相等的盐酸和HCOOH溶液的pH时,某同学先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测,用此法误差较大的是________(填“盐酸”或“HCOOH”),原因是 。
③将少量CO2通入NaCN溶液中,它们是否能反应(若能,写出反应的离子方程式;若不能,直接填“否”) 。
(2)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:
①M、N点对应的温度分别是T1、T2,则T1 T2(填“>”、“=”或“<”)。
②T2时,水的离子积常数Kw= ,pH=9的NaOH溶液中,由水电离产生的c(H+)= mol/L。
硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H++SO42-.
H++SO42-.
请据此回答下列有关问题:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),原因是: (用离子方程式表示)
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式: ;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是 。(填编号)
| A.c(SO42-)+c(HSO4-)=0.1 mol·L-1 | B.c(SO42-)+c(HSO4-)=2 c(Na+) |
| C.c(OH-)=c(H+)+c(HSO4-) | D.c(Na+)+c(H+)=c(OH-)+c(HSO4-) |
(4)已知0.1 mol·L-1的NaHSO4溶液的pH=2,则0.1 mol·L-1的H2SO4溶液中SO42-的浓度 0.01mol·L-1(填“>” “="”" 或“<”)。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=___________mol·L-1。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 |
电离平衡常数(25℃) |
| HCN |
K=4.9×10-10 |
| CH3COOH |
K=1.8×10-5 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+) ________
c(CH3COO-)(填“>”、“<”或“=”)。
②25℃时,有等浓度的①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,三种溶液的pH由大到小的顺序为___________。(填序号)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_________________________________。
已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
| A.c (CH3COO-)>c (Na+)>c (H+)>c (OH-) | B.c (CH3COO-)>c (Na +)>c (OH-)>c (H+) |
| C.c (CH3COO-)>c (H+)>c (Na+)>c (OH-) | D.c (Na+)>c(CH3COO-)>c (OH-)>c (H+) |
(1)这四组关系中有一组是不可能的,这组关系是 (选填序号)。
(2)若该溶液只有一种溶质,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(3)若上述关系中C是正确的,则溶液中溶质的化学式是 。
(4)若该溶液由体积相等的醋酸和NaOH溶液混合而成,且恰好呈中性,则:
混合前c(CH3COOH) c(NaOH)(填“>”、“<”、或“=”,下同);
混合后溶液中c(Na+) c(CH3COO-)。
氮元素能形成多种多样的化合物.请回答:
(1)298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g)△H=﹣a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g)△H=﹣a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:

①298k时,该反应的平衡常数为 L•mol﹣1(精确到0.01);
②下列情况不能用来判断该反应是否处于平衡状态的是 ;
A.混合气体的密度保持不变; B.混合气体的颜色不再变化;C.混合气体的气体压强保持不变
③若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时v(正) v(逆)(填“>”、“<”或“=”).
(2)常温条件下,向100mL 0.1mol•L﹣1NH4HSO4溶液中滴加0.1mol•L﹣1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.试分析图中a、b、c、d、e五个点(该条件下硫酸第二步电离是完全的).
①a点溶液的pH 1(填“>”“<”或“=”);
②b点溶液中发生水解反应的离子是 ;
③c点溶液中各离子浓度由大到小的排列顺序为 ;
④d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”).
25 ℃时,电离平衡常数:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
|
| 电离平衡常数 |
1.8×10-5 |
K1 4.3×10-7 K2 5.6×10-11 |
3.0×10-8 |
|
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是_____________;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(2)下列反应不能发生的是: ;
a.CO32- + CH3COOH=CH3COO- + CO2 ↑ + H2O
b.ClO- + CH3COOH=CH3COO- + HClO
c.CO32- + HClO=CO2 ↑+ H2O + ClO-
d.2 ClO- + CO2 + H2O=CO32-+ 2 HclO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是_________;
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/ KW D.c(H+)/c(OH-)
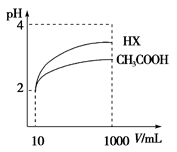
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)
(5)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 mol·L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。计算:
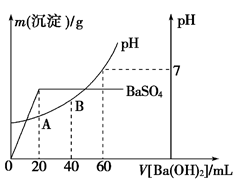
①原混合溶液中c(H+)=___________________;c(Cl-)=_________________。
②A点的pH=_________________。
③将0.15 mol·L-1稀硫酸V1mL与0.1 mol·L-1NaOH溶液V2mL混合,所得溶液pH为1,则V1∶V2=
(溶液体积变化忽略不计)。