(10分)某化学课外小组为测定空气中CO2的含量,进行了如下实验:
①配制0.1000 mol/L 和0.01000 mol/L的标准盐酸。
②将2~3滴酚酞加入未知浓度的B a(OH)2溶液10.00 mL中,并用0.1000 mol/L的标准盐酸进行滴定,结果用去盐酸19.60 mL。
a(OH)2溶液10.00 mL中,并用0.1000 mol/L的标准盐酸进行滴定,结果用去盐酸19.60 mL。
③用测定的Ba(OH)2溶液吸收定量空气中的CO2。取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里加水至刻度线,取出稀释后的溶液放入密闭容器内,并通入10 L标准状况下的空气,振荡,这时生成沉淀。
④过滤上述所得浊液。
⑤取滤液20.00 mL,用0.01000 mol/L的盐酸滴定,用去盐酸34.80 mL。
请回答下列问题:
(1)配制标准盐酸时,需用下列哪些仪器? 。
| A.托盘天平 | B.容量瓶 | C.酸式滴定管 | D.量筒 E.烧杯 F.胶头滴管 G.玻璃棒 |
(2)②操作中到达滴定终点时的现象是 。
(3)Ba(OH)2溶液的物质的量浓度是________。
(4)此空气样品中含CO2的体积分数为________。
(5)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即注入第二种标准盐酸,并进行第二次滴定,使测定结果________(填“偏大”“偏小”或“无影响”)。
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
| 变色范围(pH) |
5.0~8.0 |
3.1~4.4 |
4.4~6.2 |
8.2~10.0 |
(1)该实验应选用 作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是 。 
(2)上图表示50mL,滴定管中液面的位置,若A与C刻度间相差1mL,
A处的刻度为25,滴定管中液面读数应为 mL。,此时滴定管中液体的体积 .
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL, NaOH标准漓浓度为c mol·L-1,三次实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
消耗 溶液体积/mL 溶液体积/mL |
26.02 |
25.32 |
25.28 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
| A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积 |
| B.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗 |
| D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗 |
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(不必化简): 。
(4分)限使用下列试剂:酚酞、石蕊、稀氨水、氯化铵晶体、浓盐酸、熟石灰粉末、醋酸铵晶体和蒸馏水,根据①弱碱在水中存在电离平衡 ②弱碱的阳离子会破坏水的电离平衡,这两平衡的移动均会引起指示剂颜色的变化。由此可分别选用上述试剂,设计两种实验证明NH3·H2O是弱碱,请简述实验方法及现象:
(1)应用根据①的实验方法及现象_______________。
(2)应用根据②的实验方法及现象_______________。
(1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者 后者(填“<”、“>”或“=”).
(2)在25℃条件下将pH=5的氯化铵溶液稀释100倍 ,稀释后溶液的pH为(填选项字母,下同) .
,稀释后溶液的pH为(填选项字母,下同) .
A.5 B.7 C.3~5之间 D.5~7之间
(3)将体积和物质的量浓度都相同的醋酸和氢氧化钠溶液混合后,溶液呈 性(填“酸”,“中”或“碱”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<”,下同 )。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性,溶液中c(Na+) c(CH3COO-)
(5)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
(6)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是 。(多选、错选不得分)
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
E.未用标准液润洗碱式滴定管。
以碳酸镁(含少量FeCO3)为原料制取硫酸镁晶体,并测定Mg2+含量:将原料完全溶于一定量的稀硫酸中,加足量的H2O2后用氨水调节溶液的pH,静置后过滤,除去滤渣,将滤液结晶得硫酸镁晶体。
(1)30.00mL 5.00 mol·L-1的稀硫酸至少能溶解原料的质量为 。
(2)加入H2O2时反应的离子方程式为 。
(3)已知:Ksp[Fe(OH)3]=1.0×10-39,Ksp[Mg(OH)2]=1.0×10-12。
室温下,若溶液中c(Mg2+)=0.01mol·L-1,欲使溶液中的c(Fe3+)≤1×10-6mol·L-1,需调节溶液pH范围为 。
(4)常采用下列方法测定结晶硫酸镁中Mg2+的含量:
已知:①在pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2-)形成配合物
②在pH为5~6时,Zn2+除了与EDTA反应,还能将Mg2+与EDTA形成的配合物中的Mg2+“置换”出来: Zn2+ +MgH2Y=ZnH2Y+Mg2+
步骤1:准确称取得到的硫酸镁晶体1.50g加入过量的EDTA,配成100mL pH在9~10之间溶液A
步骤2:准确移取25.00mL溶液A于锥形瓶中,用0.10mol·L-1Zn2+标准溶液滴定,滴定到终点,消耗Zn2+标准溶液的体积为20.00mL
步骤3:准确移取25.00mL溶液A于另一只锥形瓶中,调节pH在5~6;用0.10mol·L-1Zn2+标准溶液滴定,滴定至终点,消耗Zn2+标准溶液的体积为30.00mL。
计算该结晶硫酸镁中Mg2+的质量分数(请给出计算过程) 。
.(8分)设计实验证明弱酸的酸性:醋酸>碳酸>硼酸。提供的试剂有: 溶液、
溶液、 溶液、
溶液、 溶液、硼酸(
溶液、硼酸( )溶液、
)溶液、 溶液、
溶液、 溶液。
溶液。
(1)证明酸性醋酸>碳酸的操作方法是(简述): ,化学方程式是 。
(2)证明酸性:碳酸>硼酸的操作方法是(简述): ,得出“酸性碳酸>硼酸”的结论的现象或理由是(简述) 。
天津“8.12"爆炸中扩散的CN-造成部分水体污染。某小组欲检测污水中CN-的浓度并模拟电化学法除去CN-。
探究I 检测CN-浓度
资料:碱性条件下发生离子反应:2CN- +5 H2O2+9OH-=2CO32-+N2+6H2O
实验装置如图(其中加热、夹持装置省略)。(不考虑污水中其它离子反应)

(1)加入药品之前的操作是 ;C中试剂是
(2)实验步骤如下:
| 步骤1 |
关闭K1,打开K2,滴入足量H2O2溶液,对B加热。充分反应后,停止加热 |
| 步骤2 |
________,用注射器穿过B装置的胶塞注入___________溶液。 |
| 步骤3 |
打开K1,通入N2。 |
(3)计算CN-的浓度,需称得的质量是 。
(4)为了使检测更加准确,上述(2)中操作要特别注意一些事项。请写出至少一条 。
探究Ⅱ 电化学法处理CN-的影响因素
由下图装置模拟电化学法实验,有关结果如右表。

(5)根据表格信息分析。
①X电极名称:________________;
②实验(1)中X换成Zn,则电流计读数的范围为________________
③若乙装置中阳极产生无毒无害物质,其电极方程式为 ;该实验说明电化学法处理CN-,影响处理速率的因素有 (至少两条)。
某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
| A.移取20 mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.用标准溶液润洗滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2 cm |
E.调节液面至“0”或“0”以下某一刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)__________________;
(2)上述B步骤操作的目的是_______________________;
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是______________;
(4)判断到达滴定终点的实验现象是______________________;
(5)若滴定时在晃动锥形瓶的过程中不小心将液体洒出,对实验结果的影响是_______;
(6)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是__________________________________。
某烧碱溶液中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.在250ml的容量瓶中定容成250ml烧碱溶液; |
| B.用碱式滴定管取25ml烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂; |
| C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为Mmol/L的标准硫酸溶液装入酸式滴定管,调整液面,记下开始刻读数为V1ml |
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻读数为V2 ml
回答下列问题:
①正确的操作步骤的顺序是 → → →D → .
②操作E中在锥形瓶下垫一张白纸的作用 。
③操作D中液面应调整到 ,尖嘴部分应 。
④滴定终点时瓶内溶液的PH约为 ,终点时颜色变化是 。
⑤若酸式滴定管没有用标准硫酸溶液润洗,会对测定结果有何影响? (填偏高、偏低、无影响,其他操作均正确)
⑥该烧碱样品的纯度计算式为 。
常温下有浓度为0.1mol/L、体积为VL的氨水,向其中逐滴加入一定浓度的盐酸,得到如图的滴定曲线,其中d点时两种溶液恰好完全反应。根据图像回答下列问题:
(1)上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH如下表,请将表格补充完整:
| 离子浓度大小顺序 |
溶质化学式 |
溶液的pH |
| c (NH4+)>c (OH-)>c (CI-)>c (H+) |
① |
>7 |
| ② |
③ |
=7 |
| ④ |
NH4Cl |
⑤ |
(2)该温度时氨水的电离平衡常数K数值约为____________。滴定过程中所用盐酸的pH=____________。
(3)若取该实验中恰好完全反应的d点溶液,向其中滴加0.1VL某浓度的氨水后溶液呈中性,依(2)中计算结果计算所滴加氨水的浓度为____________ moI/L。
下图是用0.1000 mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
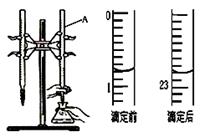
(1) 仪器A的名称是 ;
(2) 盐酸的体积读数:滴定前读数为 mL,滴定后读数为 mL 。
(3) 某实验小组同学的三次实验的实验数据如下表所示。 根据表中数据计算出的待测NaOH溶液的平均浓度是 mol/L。(保留四位有效数字)
| 实验 编号 |
待测NaOH溶液的体积(mL) |
滴定前盐酸的 体积读数(mL) |
滴定后盐酸的 体积读数(mL) |
| 1 |
20.00 |
1.20 |
23.22 |
| 2 |
20.00 |
2.21 |
24.21 |
| 3 |
20.00 |
1.50 |
23.48 |
(4)若用酚酞做指示剂,判断到达滴定终点的实验现象是_____________
(5) 对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
① 若滴定前锥形瓶未用待测液润洗,对测定结果的影响是 ;
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失。_________
③标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是 ;
某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)上述(B)操作的目的是___________________________________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________。
(4)实验中用左手控制_________(填仪器及部位),眼睛注视_______,直至滴定终点。判断到达终点的现象是___________。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是___________________________________。
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是______。
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液。
其操作可分解为如下几步:
a. 移取20.00mL待测的NaOH溶液注入洁净的锥形瓶,并加入2-3滴酚酞
b. 用标准盐酸溶液润洗滴定管2-3次
c. 把盛有标准溶液的酸式滴定管固定好,调节液面使滴定管尖嘴充满溶液
d. 取标准盐酸溶液注入酸式滴定管至0刻度以上2-3cm
e. 调节液面至0或0刻度以下,记下读数
f. 把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)_____________________。
(2)滴定终点时溶液的颜色变化是 。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________。
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(4)若某次滴定开始和结束时,酸式滴定管中的液面如图所示,则反应消耗盐酸的体积为_____ mL。

(5)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 |
待测NaOH溶液的体积/mL |
0.1000mol/L盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.20 |
20.22 |
|
| 第二次 |
25.00 |
0.56 |
24.54 |
|
| 第三次 |
25.00 |
0.42 |
20.40 |
|
依据上表数据求得NaOH溶液的物质的量浓度为 (保留4位有效数字)。
现用物质的量浓度为a mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是________________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入________(填“甲”或“乙”)中。
(3)如图是碱式滴定管中液面在滴定前后的读数,c(HCl)________mol·L-1。
下图是用0.1000 mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
(1)仪器A的名称____________;
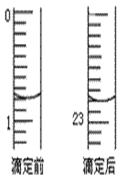
(2) 盐酸的体积读数:滴定前读数为_________mL,滴定后读数为____________ mL;
(3)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的浓度是___________________(保留四位有效数字) ;
| 实验 编号 |
待测NaOH溶液 的体积(mL) |
滴定前盐酸的 体积读数(mL) |
滴定后盐酸的 体积读数(mL) |
| 1 |
20.00 |
1.20 |
23.22 |
| 2 |
20.00 |
2.21 |
24.21 |
| 3 |
20.00 |
1.50 |
23.48 |
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00 mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是______________________________(用序号字母填写);
(5)判断到达滴定终点的实验现象是_______________________________。
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
① 如果上述B步骤省略,对测定结果的影响是_____________________ ;
②标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是_______________。