江苏省淮安、宿迁、连云港、徐州苏北四市高三上学期期末化学试卷
2015年巴黎气候变化大会召开,旨在保护环境造福人类。下列说法不正确的是
| A.扩大铅蓄电池、汞锌锰干电池的生产,满足消费需求 |
| B.采用碳捕集和储存技术,逐步实现二氧化碳的零排放 |
| C.对工业废水、生活污水净化处理,减少污染物的排放 |
| D.催化处理汽车尾气,减轻氮氧化物污染和光化学烟雾 |
下列有关氮元素及其化合物的表示正确的是
A.质子数为7、中子数为8的氮原子: |
B.溴化铵的电子式: |
C.氮原子的结构示意图: |
D.间硝基甲苯的结构简式: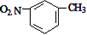 |
下列说法正确的是
| A.Fe在少量Cl2中燃烧生成FeCl2 |
| B.石油的裂解、煤的干馏都是化学变化 |
| C.化学反应的焓变与反应的途径有关 |
| D.等质量的铜按a、b两种途径完全转化为硝酸铜,途径a、b消耗的硝酸一样多 |
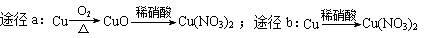
H2S在O2中不完全燃烧生成S和H2O。下列说法正确的是
| A.氧元素的单质存在同素异形体 | B.微粒半径:O2-> S2- |
| C.还原性:H2S<H2O | D.该反应中化学能全部转化为热能 |
短周期元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小,Y原子在周期表中处于族序数等于周期序数3倍的位置,Z是最外层电子数最少的金属元素,W与Y属于同一主族。下列叙述正确的是
| A.原子半径:W>Z>Y |
| B.元素W最高价氧化物的水化物为强酸 |
| C.化合物X2Y、Z2Y中化学键的类型相同 |
| D.元素Y的简单气态氢化物的热稳定性比W的弱 |
常温下,下列各组离子一定能在指定溶液中大量共存的是
| A.pH=1的溶液:Ag+、Al3+、Cl-、SO42- |
| B.能使酚酞试液变红的溶液:Na+、K+、HCO3-、S2- |
| C.c(OH-)/c(H+)=10-12的溶液:NH4+、Cu2+、NO3-、Cl- |
| D.水电离产生的c(OH-)=10-12 mol·L-1的溶液:K+、Fe2+、SO42-、NO3- |
下列实验操作正确的是
| A.用装置甲收集SO2 |
| B.用装置乙制备AlCl3晶体 |
| C.中和滴定时,锥形瓶用待装液润洗 |
| D.使用分液漏斗和容量瓶时,先要检查是否漏液 |
下列指定反应的离子方程式正确的是
| A.用氨水吸收足量的SO2气体:2OH-+SO2=SO32- + H2O |
| B.NaAlO2溶液中AlO2-的水解:AlO2-+2H2O=Al(OH)3 ↓+OH- |
| C.加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3=N2↑+3Cl-+3H2O |
| D.NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
一种微生物燃料电池如图所示,下列关于该电池说法正确的是
| A.a电极发生还原反应 |
| B.H+由右室通过质子交换膜进入左室 |
| C.b电极反应式为:2NO3-+10e-+12H+=N2↑+6H2O |
| D.电池工作时,电流由a电极沿导线流向b电极 |
下列说法正确的是
| A.铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 |
B.向氨水中不断通入CO2,随着CO2的增加, 不断增大 不断增大 |
| C.3C(s)+ CaO(s)=CaC2(s)+ CO(g)在常温下不能自发进行,说明该反应的△H>0 |
| D.合成氨时,其他条件不变,升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
青蒿酸是合成青蒿素的原料,可以由香草醛合成: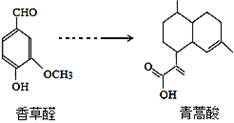
下列叙述正确的是
| A.青蒿酸分子中含有4个手性碳原子 |
| B.在一定条件,香草醛可与HCHO发生缩聚反应 |
| C.两种物质分别和H2反应,最多消耗H2 4mol和3mol |
| D.可用FeCl3溶液或NaHCO3溶液鉴别化合物香草醛和青蒿酸 |
根据下列实验现象所得结论正确的是
| 选项 |
实验 |
现象 |
结论 |
| A |
取少量食盐溶于水,加稀硫酸酸化,再滴入淀粉溶液 |
溶液未呈蓝色 |
该食盐中不含有碘酸钾 |
| B |
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置 |
下层溶液显紫红色 |
Fe3+的氧化性大于I2 |
| C |
向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液 |
均有沉淀 |
蛋白质均发生了变性 |
| D |
将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液 |
白色沉淀逐渐变为蓝色沉淀 |
Ksp[Cu(OH)2]<Ksp [Mg(OH)2] |
常温下,下列溶液中微粒的物质的量浓度关系正确的是
| A.将等体积、等物质的量浓度的CH3COONH4与CH3COONa溶液混合:c(CH3COO-)>c(Na+)>c(NH4+)>c(OH-) |
| B.将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3·H2O) |
| C.向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-) |
| D.向0.10mol·L-1 Na2CO3溶液中通入少量CO2的溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g) CH3OH(g)。在体积一定的密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g)。在体积一定的密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
A.该反应的△H<0,且p1<p2
B.反应速率:ν逆(状态A)>ν逆(状态B)
C.在C点时,CO转化率为75%
D.在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
工业上处理含铬(主要成分是HCrO4-)污水并制备磁性铁铬氧体工艺流程如下:
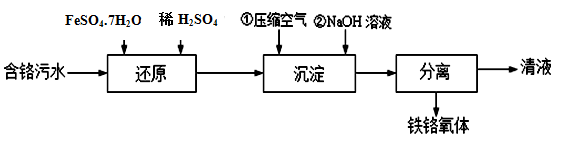
(1)还原过程中HCrO4-转化为Cr3+ 的离子方程式为 ;
(2)当沉淀池中c(Fe2+):c(Fe3+)=2:1时,能生成铁铬氧体。通入压缩空气是形成铁铬氧体的必要条件之一,通入压缩空气的目的是 、 。在加NaOH溶液之前通入的空气量不宜过多,若过多必须向沉淀池中增补的物质可能为: 。(填字母)
| A.FeSO4 | B.Cu | C.H2O2 | D.Fe |
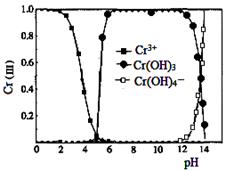
(3)已知三价铬[Cr(Ⅲ)]在水溶液中的存在形态随pH 的变化如右图,为尽可能除去铬元素实现清液达标排放,沉淀池中pH要控制在 ;若pH过高,溶液中残留铬量增大,其原因为 。
酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成:

(1)酮洛芬中含氧官能团的名称为 和 。
(2)化合物E的结构简式为 ;由C→D的反应类型是 。
(3)写出B→C的反应方程式 。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式 。
Ⅰ、能发生银镜反应;Ⅱ、与FeCl3发生显色反应;III、分子中含有5种不同化学环境的氢
(5)请写出以甲苯和乙醇为原料制备化合物 的合成路线流程图(无机试剂可任选)。合成路线流程图示例如图:
的合成路线流程图(无机试剂可任选)。合成路线流程图示例如图:

以碳酸镁(含少量FeCO3)为原料制取硫酸镁晶体,并测定Mg2+含量:将原料完全溶于一定量的稀硫酸中,加足量的H2O2后用氨水调节溶液的pH,静置后过滤,除去滤渣,将滤液结晶得硫酸镁晶体。
(1)30.00mL 5.00 mol·L-1的稀硫酸至少能溶解原料的质量为 。
(2)加入H2O2时反应的离子方程式为 。
(3)已知:Ksp[Fe(OH)3]=1.0×10-39,Ksp[Mg(OH)2]=1.0×10-12。
室温下,若溶液中c(Mg2+)=0.01mol·L-1,欲使溶液中的c(Fe3+)≤1×10-6mol·L-1,需调节溶液pH范围为 。
(4)常采用下列方法测定结晶硫酸镁中Mg2+的含量:
已知:①在pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2-)形成配合物
②在pH为5~6时,Zn2+除了与EDTA反应,还能将Mg2+与EDTA形成的配合物中的Mg2+“置换”出来: Zn2+ +MgH2Y=ZnH2Y+Mg2+
步骤1:准确称取得到的硫酸镁晶体1.50g加入过量的EDTA,配成100mL pH在9~10之间溶液A
步骤2:准确移取25.00mL溶液A于锥形瓶中,用0.10mol·L-1Zn2+标准溶液滴定,滴定到终点,消耗Zn2+标准溶液的体积为20.00mL
步骤3:准确移取25.00mL溶液A于另一只锥形瓶中,调节pH在5~6;用0.10mol·L-1Zn2+标准溶液滴定,滴定至终点,消耗Zn2+标准溶液的体积为30.00mL。
计算该结晶硫酸镁中Mg2+的质量分数(请给出计算过程) 。
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
其它性质 |
| SO2Cl2 |
-54.1 |
69.1 |
①易水解,产生大量白雾 ②易分解:SO2Cl2  SO2↑+Cl2↑ SO2↑+Cl2↑ |
| H2SO4 |
10.4 |
338 |
吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器A冷却水的进口为 (填“a”或“b”)。
(2)仪器B中盛放的药品是 。
(3)实验时,装置丁中发生反应的离子方程式为 。
(4)装置丙的作用为 ,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为 。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 + SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是 。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液): 。
为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量。
(1)用CH4催化还原煤燃烧产生的氮氧化物,可以消除污染。
已知:CH4(g) + 2NO2(g)=N2(g) +CO2(g) + 2H2O(g) △H=-867.0 kJ/mol
NO2(g)= N2O4(g) △H=-28.5 kJ/mol
N2O4(g) △H=-28.5 kJ/mol
写出CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式 。
(2)一定条件下,将NO2与SO2以体积比1∶2置于恒温恒容的密闭容器中,发生NO2(g)+SO2(g) SO3(g)+NO(g),测得反应达到平衡时NO2与SO2体积比为1∶5,则平衡常数K= (填数值)。
SO3(g)+NO(g),测得反应达到平衡时NO2与SO2体积比为1∶5,则平衡常数K= (填数值)。
(3)如图1是一种用NH3、O2脱除烟气中NO的原理,该原理中NO最终转化为H2O和 (填化学式),当消耗1mol NH3和0.5molO2时,除去的NO在标准状况下的体积为 L。
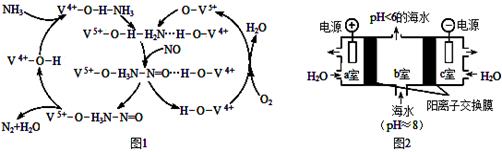
(4)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。有人利用图2所示装置(均为惰性电极)从海水中提取CO2(海水中无机碳95 % 以HCO3-存在),有利于减少环境中温室气体含量。
①a室的电极反应式为 。
②b室中提取CO2的反应的离子方程式为 。
③b室排出的海水(pH<6)不可直接排回大海,需用该装置中产生的物质对b室排出的海水进行处理,合格后才能排回大海。处理的方法是 。
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。
(1)Cu2+基态核外电子排布式为 ;[Cu(NH3)4]SO4·H2O中,与Cu2+形成配位键的原子是 (填元素符号)。
(2)乙醇分子中O原子轨道杂化类型为 。与NH3互为等电子体的一种阳离子为 (填化学式)。
(3)N、O、S第一电离能由大到小的顺序为 。
(4)某含有结晶水的铜的氯化物的晶胞结构如右图所示,该化合物的化学式是 。

乙酰苯胺为无色晶体,有“退热冰”之称。其制备原理为:

已知:①苯胺易被氧化;②苯胺、醋酸和乙酰苯胺的部分物理性质如下表:
| 试剂名称 |
熔点℃ |
沸点℃ |
溶解度(20 ℃) |
| 苯胺 |
-6.2 |
184.4 |
稍溶于水(3.4g),与乙醇、乙醚、苯混溶 |
| 乙酸 |
16.7 |
118 |
易溶于水、乙醇、乙醚等 |
| 乙酰苯胺 |
114~116 |
280~290 |
0.46g |
制备乙酰苯胺的实验步骤如下:
步骤1:在下图1装置的圆底烧瓶中,加入6.0 mL苯胺、9.0 mL冰醋酸及0.2g锌粉。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,抽滤,洗涤,得到粗产品。
步骤4:通过重结晶提纯粗产品后,获得无色片状晶体,干燥后得目标产品。

图1 图2
(1)仪器a的名称为 。
(2)步骤1中加入锌粉的作用是 。
(3)步骤2中控制温度计示数约105 ℃的原因是 。
(4)步骤3中,抽滤装置如图2所示,仪器c的名称是 ,当过滤的溶液具有强酸性、强碱性或强氧化性时要用 代替布氏漏斗,停止抽滤时的操作为 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号