四川省成都市高三上学期第一次诊断性检测理综化学试卷
下列有关物质应用正确的是
| A.氯气、明矾净水原理相同 |
| B.过氧化钠、活性炭均可用于呼吸面具 |
| C.硅胶和铁粉均可用于食品的防氧化 |
| D.甲烷的氯代物均可作防火材料 |
用NA表示阿伏加德罗常数值。下列叙述正确的是
| A.标况下,1molC6 H12 O6含氧原子数为6NA |
| B.0. 1moICl2与足量水充分混合,转移电子数为0.1NA |
| C.25℃,pH=13的Ba(OH)2溶液含有OH-数目为0.2NA |
| D.22.4L N2和NH3混合气体含共用电子对数目为3NA |
已知某药物具有抗痉挛作用,制备该药物其中一步反应为:
下列说法不正确的是
| A.a中参加反应的官能团是羧基 |
| B.生活中b可作燃料和溶剂 |
| C.c极易溶于水 |
| D.该反应类型为取代反应 |
短周期主族元素X、Y、Z、W在周期表中的相对位置如图,四种元素的原子最外层电子数之和为20。下列说法正确的是
| A.W位于第三周期ⅥA族 |
| B.元素最高正价:Z>Y>X |
| C.简单气态氢化物稳定性:W>Y>X |
| D.工业上催化氧化Y的氢化物可用于制备其含氧酸 |
溶液X中含有右表离子中的某5种,且其浓度均为 0.1mol/L(不考虑水的电离与离子水解)。向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化。下列叙述不正确的是
| 阳离子 |
阴离子 |
| Na+Ca2+ Fe2+Al3+ Fe3+ Mg2+ |
OH- HCO3-CO32-Cl-NO3- SO42- |
A.X溶液中不可能含有HCO3-或CO32-
B.生成无色气体的离子方程式为:3Fe2+ +NO3-+4H+=3Fe3++NO+2H2O
C.根据电荷守恒,原溶液中一定含Mg2+
D.X溶液中一定含3种阳离子、2种阴离子
常温下,向20mL的某稀H2SO4溶液中滴入0. 1mol/L氨水,溶液中水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是
A.稀硫酸的浓度为0.1mol/L
B.C点溶液pH=14-a
C.E溶液中存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D.B到D、D到F所加氨水体积一定相等
某化学小组用淀粉制取食品包装高分子材料B和具有果香味的物质D。其转化关系如下:

(1) C6H12O6名称是 ;A的电子式是 。
(2)写出下列反应方程式:
①淀粉一C6H12O6:
②C—D:
(3)写出常温下能与NaHCO3溶液反应的D的所有同分异构体的结构简式:
工业合成氨是人工固氮方法之一。
I.已知下列物质的键能:

则N2(g)+3H2(g)=2NH3(g) △H=_____________。
Ⅱ.恒温下,将一定量N2、H2置于10L的容器中发生反应,反应过程中各物质浓度随时间变化如下图。
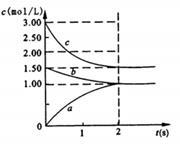
(1)图中0~2s内的反应速率v(H2)= ;该温度下平衡常数的计算表达式为__________。
(2)该反应达到平衡的标志为 (填序号)。
| A.混合气体的平均相对分子质量不变 |
| B.物质的量浓度比等于系数比 |
| C.容器内温度不变 |
| D.断裂1moIH-H键同时断裂2molN-H键 |
(3)若其它条件不变,将恒容条件变为恒压,则平衡时c(N2) (填“增大”、“减小”、“不变’’或“不能确定”)。
(4)哈伯研究所因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖。若用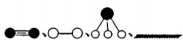 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:

①吸附后,能量状态最低的是 (填字母序号)。
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图。从吸附和解吸过程分析,c0前速率增加的原因可能是 ;c0后速率降低的原因可能是 。

天津“8.12"爆炸中扩散的CN-造成部分水体污染。某小组欲检测污水中CN-的浓度并模拟电化学法除去CN-。
探究I 检测CN-浓度
资料:碱性条件下发生离子反应:2CN- +5 H2O2+9OH-=2CO32-+N2+6H2O
实验装置如图(其中加热、夹持装置省略)。(不考虑污水中其它离子反应)

(1)加入药品之前的操作是 ;C中试剂是
(2)实验步骤如下:
| 步骤1 |
关闭K1,打开K2,滴入足量H2O2溶液,对B加热。充分反应后,停止加热 |
| 步骤2 |
________,用注射器穿过B装置的胶塞注入___________溶液。 |
| 步骤3 |
打开K1,通入N2。 |
(3)计算CN-的浓度,需称得的质量是 。
(4)为了使检测更加准确,上述(2)中操作要特别注意一些事项。请写出至少一条 。
探究Ⅱ 电化学法处理CN-的影响因素
由下图装置模拟电化学法实验,有关结果如右表。

(5)根据表格信息分析。
①X电极名称:________________;
②实验(1)中X换成Zn,则电流计读数的范围为________________
③若乙装置中阳极产生无毒无害物质,其电极方程式为 ;该实验说明电化学法处理CN-,影响处理速率的因素有 (至少两条)。
硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取t,其工艺流程如下图所示。

(1)为提高锌灰的浸取率,可采用的方法是 (填序号)。
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是 (写化学式)。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为____________。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是 ,
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取。化学反应方程式为______________;
③已知Na2SO4.10H2O及Na2SO4的溶解度随温度变化曲线如图。从滤液中得到Na2SO4.10H2O的操作方法是________________。

(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL、物质的量浓度为c mol/L的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为____________。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号