[浙江]2013-2014学年浙江省杭州地区七校高二上学期期中考试化学试卷
下列说法不正确的是( )
| A.元素分析仪可同时对有机物中碳、氢、氧、硫等多种元素进行分析,其特点是样品量少,速度快 |
| B.1H核磁共振谱能反映出有机物中不同环境氢原子的种数和个数 |
| C.根据红外光谱图的分析可以初步判断有机物中具有哪些基团 |
| D.同位素示踪法可以用来确定有机反应中化学键的断裂位置 |
下物质分类组合正确的是 ( )
| |
A |
B |
C |
D |
| 强电解质 |
HBr |
FeCl3 |
H3PO4 |
Ca(OH)2 |
| 弱电解质 |
HF |
CH3COOH |
BaSO4 |
HI |
| 非电解质 |
NH3 |
Cu |
H2O |
C2H5OH |
下列化学用语表达正确的是( )
| A.甲烷的标准燃烧热△H="-890.3" kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H="-890.3" kJ·mol-1 |
B.丙烯的键线式: |
C.一定条件下,某密闭容器中充入2 mol SO2(g)和1 mol O2(g),达到平衡后,放出Q kJ热量,则该条件下的热化学方程式为:2SO2(g)+O2(g) 2SO3(g )△H=" -Q" kJ·mol-1 2SO3(g )△H=" -Q" kJ·mol-1 |
| D.乙烯的结构简式:CH2CH2 |
某学生实验仪器的选择及数据记录,都合理的是( )
| A.酸碱中和滴定时,用10mL量筒量取10.00mL待测液 |
| B.用托盘天平称量25.20gNaCl固体 |
| C.常温条件下,用广泛pH试纸测得纯水的pH为7.0 |
| D.用500mL容量瓶配制480mL0.100mol/LNaOH溶液 |
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b﹤d。符合上述实验结果的盐溶液是( )
| 选项 |
X |
Y |
| A. |
MgSO4 |
CuSO4 |
| B. |
AgNO3 |
Pb(NO3)2 |
| C. |
FeSO4 |
Al2 (SO4)3 |
| D. |
CuSO4 |
AgNO3 |
下列离子方程式中,正确的是( )
A.氯气通入水中,溶液呈酸性:Cl2+H2O  2H++Cl-+ClO- 2H++Cl-+ClO- |
B.用铜做电极电解CuSO4溶液:2Cu2++2H2O 2Cu +O2↑+4H+ 2Cu +O2↑+4H+ |
C.NaHS电离方程式:NaHS  Na++HS- Na++HS- |
D.NH4Cl水解反应:NH4++2H2O  NH3·H2O+H3O+ NH3·H2O+H3O+ |
在下列溶液中,各组离子一定能够大量共存的是( )
| A.25℃由水电离的c(H+)= 10-12mol/L 的溶液:Fe3+ Cl-NO3- K+ |
| B.使酚酞变红的溶液:Na+ Cl- SO42-AlO2- |
| C.某无色溶液:HCO3-NO3- Al3+ Ba2+ |
| D.25℃时,pH=1的溶液: Ba2+ NO3- K+ I- |
高温下,某反应达到平衡,平衡常数 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的化学方程式为CO+H2O CO2+H2 CO2+H2 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.该反应的焓变为正值 |
下列有机实验操作或叙述正确的是( )
| A.甲烷和氯气在室温下的黑暗环境中可以稳定存在 |
| B.苯与浓硝酸、浓硫酸共热并保持100℃-110℃反应生成一取代产物硝基苯 |
| C.苯能使溴水褪色是因为二者反应生成了溴苯 |
| D.要除去乙烷中的乙烯制得纯净的乙烷,可将混合气通入酸性高锰酸钾溶液中 |
下列物质:①乙烷 ②乙烯 ③乙炔 ④苯 ⑤甲苯 ⑥聚乙烯,其中既能与溴水反应又能与酸性高锰酸钾溶液反应的是( )
| A.②③④ | B.②③⑤ | C.②③ | D.②③⑤⑥ |
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A.1 mol甲基含7 NA个电子 |
| B.1 mol聚乙烯含有的原子数目为6NA |
| C.标况下1 L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA /22.4 |
| D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
某有机物的分子结构如下所示:CH3- -CH=CH-C≡C-CH3,该分子中最多可以有多少个原子共面( )
-CH=CH-C≡C-CH3,该分子中最多可以有多少个原子共面( )
| A.18 | B.20 | C.22 | D.24 |
1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是( ) 
下列各组物质中,所含元素的质量分数相同,但它们既不属于同分异构体,也不属于同系物的是( )
| A.乙烯 丙烯 | B.异戊二烯 3-甲基-1-丁炔 | C.苯 苯乙烯 | D.甲烷 乙烯 |
在体积均为1L,pH均等于2的盐酸和醋酸溶液,分别投入0.23g Na,则下图中比较符合反应事实的曲线是( )
用已知浓度的NaOH溶液滴定未知浓度的醋酸,下列情况,测得结果偏高的是( )
①用酚酞作指示剂
②滴定管用水洗后,未用标准溶液润洗就装入标准溶液
③锥形瓶盛待测液前,未用待测液润洗
④标准液读数时,滴定前仰视,滴定后俯视
⑤用于取待测液的滴定管未用待测液润洗
⑥在摇动锥形瓶的过程中不慎溅出了一小部分溶液
⑦滴定达终点时发现滴定管尖嘴处挂着一滴液滴
| A.①③④ | B.②③ | C.②⑦ | D.④⑤⑥ |
对于反应:H2(g)+I2(g) 2HI(g),在一恒定压强的容器中进行,下列可以判断此反应达到平衡状态的是( )
2HI(g),在一恒定压强的容器中进行,下列可以判断此反应达到平衡状态的是( )
| A.混合气体的体积保持不变 | B.混合气体的密度保持不变 |
| C.混合气体平均相对分子质量保持不变 | D.混合气体颜色保持不变 |
用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
| A.20 mL 2 mol/L FeCl3溶液 | B.40 mL 1 mol/L NaHCO3溶液 |
| C.20 mL 1 mol/L Na2SO3溶液 | D.40 mL 2 mol/L NH4HCO3溶液 |
常温常压下,某50mL三种气态烃和足量O2混合后点燃,恢复到原来的状况,体积共缩小100mL,则该混合烃可能是( )
| A.CH4、C2H2、C2H4 | B.C2H6、C3H6、C4H6 |
| C.CH4、C3H8、C2H6 | D.C2H2、C2H4、C2H6 |
下列说法正确的是( )
A.将0.2mol/L某强碱弱酸盐NaA溶液与0.1mol/L盐酸等体积混合,混合后溶液显碱性,则混合溶液中c(HA) >c(Cl-) >c(A-)>c(OH-)
B.相同条件下,向氨水、氢氧化钠溶液中分别加入适量的氯化铵晶体后,两溶液的pH:前者减小,后者增大
C.室温条件下,将pH=3盐酸VaL与pH=11氢氧化钠溶液VbL混合,混合后溶液pH=4,假设混合后忽略体积变化,则Va∶Vb=10∶9。
D.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
下列事实不能用勒沙特列原理解释的是( )
①氯化铁溶液加热蒸干最终得不到氯化铁固体
②铁在潮湿的空气中容易生锈
③把pH=2的NaHSO4溶液加水稀释至10倍,c(OH-)却上升了10倍
④常温下,将1 mL pH=3的醋酸溶液加水稀释至l00 mL,测得其pH<5
⑤在滴有酚酞的Na2CO3溶液中滴CaCl2溶液,生成沉淀的同时溶液颜色由红逐渐变无
⑥对于H2+I2 2HI的平衡体系,加压后密闭体系中的混合气体密度增加
2HI的平衡体系,加压后密闭体系中的混合气体密度增加
⑦在双氧水的分解实验中添加MnO2能使分解速率显著加快
| A.①③④ | B.②⑥⑦ | C.③④⑤ | D.②③⑤ |
硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H++SO42-.
H++SO42-.
请据此回答下列有关问题:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),原因是: (用离子方程式表示)
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式: ;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是 。(填编号)
| A.c(SO42-)+c(HSO4-)=0.1 mol·L-1 | B.c(SO42-)+c(HSO4-)=2 c(Na+) |
| C.c(OH-)=c(H+)+c(HSO4-) | D.c(Na+)+c(H+)=c(OH-)+c(HSO4-) |
(4)已知0.1 mol·L-1的NaHSO4溶液的pH=2,则0.1 mol·L-1的H2SO4溶液中SO42-的浓度 0.01mol·L-1(填“>” “="”" 或“<”)。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。(填字母)
A.C(s)+CO2(g)="2CO(g)" △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2CO(g)+O2(g)=2CO2(1)△H<0
(2)以KOH溶液为电解质溶液,依据(1)中所选反应设计一个原电池, 其正极的电极反应式为: 。
(3)利用下图装置,可以模拟铁的电化学防护。 若X为碳棒,为减缓铁的腐蚀,开关K应该置于 (填M或者N)处,此时溶液中的阴离子向 极(填X或铁)移动。若X为锌,开光K置于M处,该电化学防护法称为: 。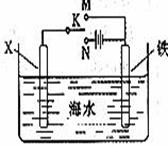
为减少污染,常将煤转化为清洁气体燃料,可将焦炭与水蒸气反应转化为氢气和一氧化碳:C(s)+ H2O(g)  H2(g)+ CO(g)
H2(g)+ CO(g)  H>0。现在容积固定为2L密闭容器中,加入2mol C(s)和2mol H2O(g),在T℃下充分反应,半分钟后达到平衡,测得H2为0.75mol。
H>0。现在容积固定为2L密闭容器中,加入2mol C(s)和2mol H2O(g),在T℃下充分反应,半分钟后达到平衡,测得H2为0.75mol。
(1)用H2O(g)表示反应开始到达到平衡的平均速率 ;
(2)计算T℃下该反应的平衡常数K= ;若温度升高,则反应平衡常数将 (填“增大”“减小”或“不变”)。
(3)上述条件下该反应达到平衡状态,下列说法正确的是
| A.缩小容器体积,平衡向左移动 | B.加入催化剂,CO的产率增大 |
| C.增加碳的量,H2O(g)的转化率增大 | D.降低温度,H2O(g)的转化率降低 |
(4)若将上述容器改为恒压容器(两个反应器初始容积相同),相同温度下加入2molC(s)和2mol H2O(g),达到平衡后,H2O(g)的转化率将 (填“增大”“减小”或“不变”)。
(1)化学式为C6H12的某烯烃的所有碳原子都在同一平面上,则该烯烃的结构简式为 ,其名称为 ;取少量该物质与氢气加成所得产物进行核磁共振分析,在核磁共振氢谱图上应该出现_____ 个峰,其面积比为 (一个峰则不填)。
(2)标准状况下1.68L无色可燃气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到白色沉淀质量为15.0g,若用足量碱石灰吸收燃烧产物,增重9.3g。若原气体是单一气体,它的分子式 。
(3)某有机物的一氯代物分子中有两个-CH3、两个-CH2-、一个 和一个-Cl,它可能的结构有 种。(本题不考虑对映异构体)
和一个-Cl,它可能的结构有 种。(本题不考虑对映异构体)
Ⅰ、德国化学家凯库勒认为苯分子的结构中,碳碳间以单、双键交替结合而成环状。为了评价凯库勒的观点,某学生设计了以下实验方案:①按下图所示的装置图连接好各仪器;②检验装置的气密性;③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开K1、K2、K3止水夹;④待烧瓶C中气体收集满后,将导管D的下端插入烧杯里的水中,关闭K2,打开K3,挤压预先装有水的胶头滴管的胶头,观察实验现象。
试回答:
(1)写出A中发生反应的化学方程式 ;能证明凯库勒观点错误的实验现象是 ;
(2)装置B的作用是 ;
Ⅱ、用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取烧碱样品5.0g,将样品配成250mL的待测液。
(2)取10.00mL待测液,用 量取注入锥形瓶中。(填仪器)
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视 ,直到滴定终点。
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度: 。
| 滴定次数 |
待测液体积/mL |
标准盐酸体积/mL |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
10.00 |
0.50 |
20.40 |
| 第二次 |
10.00 |
4.00 |
24.10 |
| 第三次 |
10.00 |
4.20 |
25.70 |
(5)根据上述测定数据,分析得到合理数据,计算烧碱的纯度 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号