A、B、C、D、E五种溶液分别是NaOH溶液、氨水、醋酸、盐酸、NH4HSO4溶液的一种。常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol/LC与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是__________,(填化学式,下同)E是__________;
(2)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中__________曲线(填写序号).
(3)室温下,向0.01mol/LC溶液中滴加0.01mol/LD溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为__________.
(4)写出C的稀溶液和足量的D溶液反应的离子方程式______________________。
现代传感信息技术在化学实验中有广泛的应用。

Ⅰ.某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。
(1)制取氨气。烧瓶中制取NH3的化学方程式为 ,检验三颈瓶集满NH3的方法是 。
(2)关闭a,将吸有2mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2)。图2中 点时喷泉最剧烈。
Ⅱ.测定NH3•H2O的浓度及电离平衡常数Kb
(3)从三颈瓶中用 (填仪器名称)量取25.00mL氨水至锥形瓶中,用0.0500 mol•L-1HCl滴定。用pH计采集数据、电脑绘制滴定曲线如下图。

(4)据图,计算氨水的浓度为 mol•L-1;写出NH3•H2O电离平衡常数Kb的表达式,Kb= ,当pH=11.0时计算Kb的近似值,Kb≈ 。
(5)关于该滴定实验的说法中,正确的是 。
| A.锥形瓶中有少量蒸馏水不影响测定结果 |
| B.未滴加酸碱指示剂,实验结果不科学 |
| C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高 |
| D.滴定终点时俯视读数会导致测得氨水的浓度偏高 |
(12分)通常情况下,微粒A和B为分子,C为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D。假定B的水溶液(B·H2O)和盐酸充分反应后的溶液为E。请用有关的化学式或微粒符号填空:
(1)用化学符号表示下列4种微粒:A:______;B:______;C:______;D:______。
(2)若E溶液中只有一种溶质,则该溶质中包含的化学键类型是:________,_________。电子式为:___________。该溶液中有关离子浓度的大小为:____________________。
(3)若E溶液是由体积相等的稀盐酸和B的水溶液混合而成,且恰好呈中性,则混合前c(HCl)________c(B·H2O)(填“大于”、“小于”或“等于”,下同);混合前盐酸中c(H+)和B·H2O中c(OH-)的关系为c(H+)________c(OH-)。
水的电离平衡曲线如下图所示。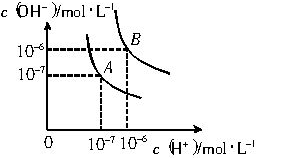
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,Ca(OH)2的离子积为 。
(4))25℃时,在等体积的 ① pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是 。
(5)等体积的下列溶液中,阴离子的总物质的量最大的是_________(填序号)。
① 0.1 mol·L-1的CuSO4溶液
② 0.1 mol·L-1的Na2CO3
③ 0.1 mol·L-1的KCl
④ 0.1 mol·L-1的NaHCO3
(6)某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H+ + HA-,HA- H+ + A2- 。
H+ + A2- 。
①则Na2A溶液显________(填“酸性”“中性”或“碱性”);NaHA溶液显________(填“酸性”“中性”或“碱性”)。
②若有0.1 mol·L-1 Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号)。
| A.c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) |
| B.c(Na+)>c(OH-)>c(HA-)>c(A2-)>c(H+) |
| C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-) |
| D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-) |
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是________________________
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
写出该混合溶液中下列算式的精确结果(不用做近似计算)。
c(Na+)-c(A-)=________mol·L-1 c(OH-)-c(HA)=________mol·L-1
(原创) 酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1) 氨水是中学常见碱
① 下列事实可证明氨水是弱碱的是 (填字母序号)。
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0. 1 mol·L-1氨水pH为11
C.铵盐受热易分解
D.常温下,0. 1mol·L-1氯化铵溶液的pH为5
② 下列方法中,可以使氨水电离程度增大的是 (填字母序号)。
A.通入氨气 B.加入少量氯化铁固体
C.加水稀释 D.加入少量氯化铵固体
(2)盐酸和醋酸是中学常见酸
用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
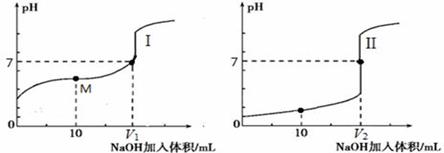
① 滴定醋酸的曲线是 (填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
(3)为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
| 步骤1:向2 mL 0.005 mol·L-1AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 |
出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1Fe(NO3)3溶液。 |
溶液变为红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴 3 mol·L-1 AgNO3溶液。 |
现象a ,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴 3 mol·L-1 KI溶液。 |
出现黄色沉淀。 |
已知:ⅠAgSCN是白色沉淀。
Ⅱ相同温度下,Ksp(AgI)= 8.3×10‾17,Ksp (AgSCN )= 1.0×10‾12 。
① 步骤3中现象a是 。
② 用沉淀溶解平衡原理解释步骤4的实验现象 。
③向50 mL 0.005 mol•L‾1的AgNO3溶液中加入150 mL0.005 mol•L‾1的 KSCN溶液,混合后溶液中Ag+的浓度约为 mol•L‾1。(忽略溶液体积变化)
在工农业生产和科学研究中,许多重要的化学反应需要在水溶液中进行,试分析并回答以下问题:
(1)向体积均为20.00 mL、浓度均为0.1 mol·L-1盐酸和醋酸溶液中分别滴加0.1 mol·L-1 NaOH溶液。随加入的NaOH溶液体积的增加,溶液pH的变化如下图所示:
①用NaOH溶液滴定醋酸溶液的曲线是__________________(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是______________溶液(填化学式);
③图中V1和V2大小的比较:V1_____V2(填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:
______>______>______>________(用离子的物质的量浓度符号填空)。
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):
资料:AgSCN是白色沉淀;Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:_____________(用必要的文字和方程式说明);
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为________(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=______________。
(14分)砷(As)广泛分布于自然界,其原子结构示意图是 。
。
(1)砷位于元素周期表中 族,其气态氢化物的稳定性比NH3 (填“强”或“弱”)。
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据下图写出As2O5分解为As2O3的热化学方程式: 。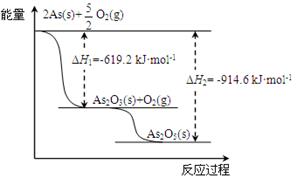
(3)砷酸盐可发生如下反应:AsO43-+2I﹣+2H+ AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。
AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。
①A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转。此时C2上发生的电极反应是 。
②一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针______(填“不动”、“向左偏”或“向右偏”)。
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样溶于NaOH溶液,得到含AsO43-和AsO33-的混合溶液。
As2O5与NaOH溶液反应的离子方程式是 。
②上述混合液用0.02500 mol·L-1的I2溶液滴定,消耗I2溶液20.00 mL。滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000 mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00 mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是 g。
(8分)KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是 。
(2)如何保证在700C~800C条件下进行滴定操作: 。
(3)准确量取一定体积的KMnO4溶液用________________(填仪器名称)。
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用_________(填序号)。
| A.H2C2O4·2H2O | B.FeSO4 | C.浓盐酸 | D.Na2SO3 |
(5)若准确称取Wg你选的基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。问:
①滴定终点标志是__________ __________;
②所配制KMnO4标准溶液的物质的量浓度为_______________mol/ L;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将____(填“偏高”或“偏低”)。
(本题共11分)氮族元素按原子序数增大,依次为:氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)。请回答:
28.常温常压下,向100mL 1.6mol/L稀氨水中逐滴滴入10mL 4.0mol/L稀硫酸,得到的溶液能使酚酞显红色。请比较所得溶液中NH4+、 NH3﹒H2O、SO42— 三种微粒的物质的量浓度大小关系: 。
29.含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢在热玻璃管中完全分解成氢气和1.50 mg单质砷。则在整个过程中,转移的电子总数为 。
30.铋酸钠(NaBiO3)溶液呈无色。向硫酸锰溶液中依次滴加下列溶液,对应的现象如表所示:
| 加入溶液 |
①适量铋酸钠溶液 |
②过量的双氧水 |
③适量KI淀粉溶液 |
| 实验现象 |
溶液呈紫红色 |
紫红色消失,产生气泡 |
溶液变成蓝色 |
请比较实验中所有的氧化剂和氧化产物的氧化性强弱关系(反应过程中的涉及的气体均不参与比较): 。
31.五氟化锑(SbF5)是无色黏稠液体,是很强的具有特殊酸性的酸,而且是超强酸氟锑酸HSbF6(目前酸性最强的酸,比纯硫酸强2×1019倍)的组分之一。SbF5可用于制备一般化学方法很难制备的氧化性极强的F2,其过程如下(均未配平):
①KMnO4 + KF + H2O2 + HF → K2MnF6 +O2 + H2O
②SbCl5 + HF → SbF5 + HCl
③K2MnF6 + SbF5 → KSbF6 + MnF3 + F2↑
反应①中氧化剂和被氧化的元素的物质的量之比为 ____;反应③中SbF5表现的性质为 ______性。
32.能在一定程度上抵消、减轻外加强酸或强碱对溶液酸度的影响,从而保持溶液的pH值相对稳定。这种溶液称为缓冲溶液。例如:人体血液中HCO3—和H2CO3等微粒形成的平衡体系,使得血液pH能稳定在7.4±0.05。某同学取19ml 0.2mol/L的NaH2PO4溶液,81ml 0.2mol/L的Na2HPO4溶液混合,配制0.2mol/L PH=7.4的磷酸缓冲溶液。已知该缓冲溶液利用的平衡体系是:H2PO4— H++HPO42—,请根据该平衡体系分析其缓冲原理: 。
H++HPO42—,请根据该平衡体系分析其缓冲原理: 。
(1)某温度下,纯水中的c(H+)=3×10-7 mol/L,滴入稀H2SO4使c(H+)=5×10-6 mol/L,则c(OH-)=__ ,由水电离出的c(H+)为_____ 。
(2)现有常温下的五份溶液:
①0.01 mol·L-1 CH3COOH溶液;
②0.01 mol·L-1 HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol·L-1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(a)其中水的电离程度相同的是 ______;(填序号)
(b)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②、③混合(填“>”、“<”或“=”);
(c)将前四份溶液同等稀释10倍后,溶液的pH: ③________④ (填“>”、“<”或“=”);
(3)现有十种物质:①蔗糖 ②熔融NaCl ③盐酸 ④铜丝 ⑤NaOH固体
⑥液氯 ⑦CuSO4固体 ⑧酒精 ⑨氯水 ⑩H2SO4
a.上述物质中可导电的是 (填序号,以下同);
b.上述物质中属于非电解质的是 。
中国环境监测总站数据显示,PM2.5、SO2、NOx等是连续雾霾过程影响空气质量显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对它们进行研究具有重要意义。请回答:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH |
SO |
NO |
Cl- |
| 浓度(mol/L) |
4×10−6 |
6×10−6 |
2×10−5 |
4×10−5 |
3×10−5 |
2×10−5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
(3)消除氮氧化物和硫氧化物有多种方法。
Ⅰ.NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
①由图可知SCR技术中的氧化剂为 。
②用Fe做催化剂时,在氨气足量的情况下,当 =1:1时,脱氮率最佳,已知每生成28g N2放出的热量为QkJ,该反应的热化学方程式为 。
=1:1时,脱氮率最佳,已知每生成28g N2放出的热量为QkJ,该反应的热化学方程式为 。
Ⅱ.工业上变“废”为宝,吸收工业中SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
①装置Ⅰ中的主要反应的离子方程式为 。
②装置Ⅲ还可以使Ce4+再生,若用甲烷燃料电池电解该装置中的溶液,当消耗1mol CH4时,
理论上可再生 mol Ce4+。
Ⅲ.用活性炭还原法可以处理氮氧化物。如发生反应:
C(s)+2NO(g) N2(g)+CO2(g) △H=Q kJ/mol。
N2(g)+CO2(g) △H=Q kJ/mol。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 时间(min) 时间(min)浓度(mol/L) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.58 |
0.40 |
0.40 |
0.48 |
0.48 |
| N2 |
0 |
0.21 |
0.30 |
0.30 |
0.36 |
0.36 |
| CO2 |
0 |
0.21 |
0.30 |
0.30 |
0.36 |
0.36 |
①Tl℃时,该反应的平衡常数K= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是________(答一种即可)。
铅及其化合物在工业生产生活中都具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g)↑H="a" kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g)↑H="b" kJ•mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g)↑H="c" kJ•mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s)△H=_____________kJ•mol-1(用含a,b,c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g) Pb(s)+CO2(g) △H,该反应的平衡常数的对数值与温度的关系如下表
Pb(s)+CO2(g) △H,该反应的平衡常数的对数值与温度的关系如下表
| 温度 |
300 |
727 |
1227 |
| lgK |
6.17 |
2.87 |
1.24 |
①该还原反应的△H____0(选填:“>”“<”“=”)。
②当lgK=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为_______。
(3)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为_______。
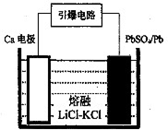
(4)PbI2:可用于人工降雨.取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图).加入酚酞指示剂,用0.0025mol•L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.可计算出t℃时PbI2 Ksp为_______。
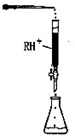
(5)铅易造成环境污染,水溶液中的铅存在形态主要有6种,它们与pH关系如图1所示,含铅废水用活性炭进行处理,铅的去除率与pH关系如图2所示.
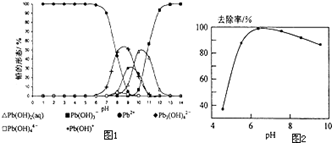
①常温下,pH=6→7时,铅形态间转化的离子方程式为____________________。
②用活性炭处理,铅的去除率较高时,铅主要应该处于________(填铅的一种形态的化学式)形态.
(8分)
Ⅰ.醋酸是常见的弱酸。用0.1 mol•L—1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol•L—1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH体积而变化的两条滴定曲线。
(1)滴定醋酸的曲线是 (填“I”或“Ⅱ”)。
(2)滴定开始前,三种溶液中由水电离出的c(H+)最大的溶液名称是 。
(3)V1和V2的关系:V1 V2(填“>”、“=”或“<”)
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
Ⅱ.草酸钴是制备钴的氧化物的重要原料。下图为二水合草酸钴(CoC2O4•2H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。
(1)通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225 ℃~300 ℃发生反应的化学方程式: 。
(2)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比 。
锰锌铁氧体可制备隐形飞机上吸收雷达波的涂料。以废旧锌锰电池为原料制备锰锌铁氧体(MnxZn1-xFe2O4)的主要流程如下,请回答下列问题: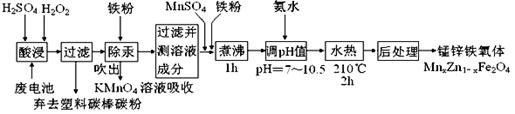
(1)酸浸时,二氧化锰被双氧水还原的化学方程式为 。
(2)活性铁粉除汞时,铁粉的作用是 (填“氧化剂”或“还原剂”或“吸附剂”)。
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸汽经KMnO4溶液进行吸收而实现的。下图是KMnO4溶液处于不同pH时对应Hg的单位时间去除率变化图,图中物质为Hg与 MnO4-在该pH范围内反应的主要产物。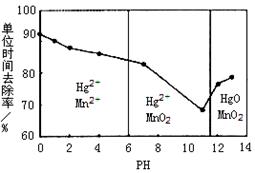
①pH<6时反应的离子方程式为 。
②请根据该图给出pH对汞去除率影响的变化规律: 。
③试猜想在强酸性环境下汞的单位时间去除率高的原因: 。(不考虑KMnO4在酸性条件下氧化性增强的因素)
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该锰锌铁氧体的组成 。
(5)经测定滤液成分后,需加入一定量的MnSO4和铁粉,其目的是 。