(1)25℃时,某NaCl溶液中c(Cl–)=1×10-4 mol·L–1,则该溶液中c(Na+)∶c(OH-)=
(2)25℃时,将0.1 mol·L–1NaOH溶液与0.06 mol·L–1的H2SO4溶液等体积混合(忽略混合后体积的变化),求所得溶液的pH= 。25℃时,pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液中氢离子浓度最接近 。
(3)25℃时,下列四种溶液中,①pH=0的盐酸 ②0.1 mol·L–1的盐酸 ③0.01 mol·L–1的NaOH溶液 ④pH=11的NaOH溶液,由水电离生成氢离子浓度之比①︰②︰③︰④是: (填字母)
| A.1︰10︰100︰1000 | B.0︰1︰12︰11 |
| C.14︰13︰12︰11 | D.14︰13︰2︰3 |
(4)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,
①则该温度下水的Kw= 。
②在该温度下测得某溶液pH=3,则该溶液中c(H+)∶c(OH-)=________。
③该温度下将pH=2的盐酸和pH=11的氢氧化钠溶液等体积混合,pH=______________
(5) 纯水中c(H+)=5.0×10–7 mol·L–1,则此时纯水中的c(OH–) = ;若温度不变,滴入稀硫酸使c(H+)=5.0×10–3 mol·L–1,则c(OH–) = ;在该温度时,往水中滴入NaOH溶液,溶液中的c(OH–)=5.0×10–2 mol·L–1,则溶液中c(H+)= 。
已知MOH为一元弱碱,25℃时,电离常数Kb= 1×10- 6mol·L-1,
(1)25℃时,将0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,此时混合溶液中由水电离出的c(H+)=Amol·L-1,若0.2 mol/L HCl溶液中由水电离出的c(H+)=Bmol·L-1,则:
①比较A B。(填“>”、“<”或“=”)
②根据电荷守恒,计算混合溶液中c(Cl-)-c(M+)=______ mol·L-1。 (精确计算,填具体数字)
(2)25℃时,0.01 mol·L-1MOH溶液的 pH=10,将其与等体积 pH = 4的盐酸溶液混合,则混合溶液的pH 7(填“>”、“<”或“=”),试求此时溶液中M Cl的水解平衡常数Kh= mol/L
常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
| 实验编号 |
HA的物质的量浓度(mol·L-1) |
NaOH的物质的量浓度(mol·L-1) |
混合后溶 液的pH |
| 甲 |
0.1 |
0.1 |
pH=7 |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,判断HA是 (填“强酸”或“弱酸”)
某同学欲利用甲组中的一元酸HA溶液滴定未知浓度的NaOH溶液,可选取 作指示剂;在滴定过程中,下列哪些操作会使结果偏高的是
A.酸式滴定管未用标准酸HA润洗,直接装入标准酸HA
B.酸式滴定管滴定前有气泡,滴定后气泡消失
C.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥
D.读取酸HA体积开始时仰视读数,滴定结束后俯视读数
E.锥形瓶用蒸馏水洗净后,再用待测NaOH溶液润洗
(2)根据乙组数据分析,乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是
(4)分析丁组数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol·L-1。
某同学取丁组试剂各100mL,充分反应后测得放出的热量为Q,写出表示中和热的热化学方程式
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO‾+H+ ΔH>0。
CH3COO‾+H+ ΔH>0。
(1)常温常压下,在 pH =5的稀醋酸溶液中,c(CH3COO‾)=_________;下列方法中,可以使0.10 mol·L‾1CH3COOH的电离程度增大的是___________。
a.加入少量0.10 mol·L‾1的稀盐酸
b.加热CH3COOH溶液
c.加入少量冰醋酸
d.加水稀释至0.010 mol·L‾1
e.加入少量氯化钠固体
f.加入少量0.10 mol·L‾1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:υ(盐酸)_________υ(醋酸)。
(3)常温下,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:Va____Vb。
(4)已知:90℃时,水的离子积常数为Kw = 38×10‾14,在此温度下,将pH=3的盐酸和pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=__________(保留三位有效数字)。
醋酸和盐酸是中学化学中常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在 pH =5的稀醋酸溶液中,c(CH3COO-)=____________(列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是______。
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:v(盐酸)_________v(醋酸)。(填写“>”、“<”或“=”)
(3)某同学用0.1000mol/LNaOH溶液分别滴定20.00mL 0.1000mol/LHCl和20.00mL0.1000mol/L CH3COOH,得到如图所示两条滴定曲线,请完成有关问题: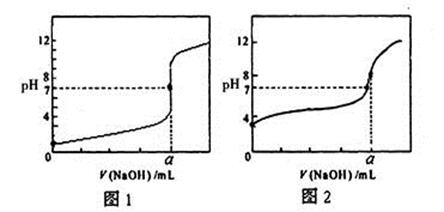
①NaOH溶液滴定CH3COOH溶液的曲线是 (填“图1”或“图2”);
②a= mL。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(5)已知:90℃时,水的离子积常数为Kw = 3.80×10-13,在此温度下,将pH=3的盐酸和
pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=____________(保留三位有效数字)mol/L。
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,Ag2CrO4为砖红色沉淀。
(1) AgCl、AgI、 Ag2CrO4三种饱和溶液中,Ag+浓度由大到小顺序是 。现将等体积2.0×10—4 mol·L-1的AgNO3溶液和一定浓度的Na2CrO4溶液混合,若要产生Ag2CrO4沉淀,则Na2CrO4溶液至少浓度为 mol·L-1。
(2) 在室温下,向0.02mol·L-1的Na2CrO4溶液中滴加0.01mol·L-1稀硫酸,溶液由黄色转变为橙红色的Na2Cr2O7,该平衡转化的离子方程式为 。Na2Cr2O7可用来鉴别NaCl和NaNO2,鉴别时发生的离子方程式为 。
(3) 工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气。结果溶液的pH值不断升高,溶液由酸性转变为碱性。在以上处理过程中,写出其阳极电极反应式: ,Cr2O72-转化为毒性较低的Cr3+的离子方程式为: 。
(4) 用AgNO3溶液滴定含Cl-的溶液,可测定溶液中的c(Cl-)。可滴入几滴 溶液为指示剂,滴定的终点现象为 。
加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解,碘酸钾的溶解度随温度升高变化不大。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
(1)步骤②中氢氧化钾的主要作用是 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过 、过滤、洗涤、干燥等步骤。
(3)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取wg食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液滴定,消耗10.00mL时恰好反应完全。
①在滴定过程中,所用的玻璃仪器为 、 。
②该实验可以用 作指示剂,滴定终点的现象是 。
③下列有关该滴定实验的说法不正确的是 。
| A.滴定管在使用前必须检查是否漏水并润洗 |
| B.滴定时眼睛注视滴定管内溶液液面变化 |
| C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁 |
| D.终点读数时俯视会导致碘的含量偏低 |
④加碘食盐样品中的碘元素含量是 g·kg-1(以含w的代数式表示)。
(1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
H2NCOONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡气体总浓度(×10—3 mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①氨基甲酸铵分解反应的焓变△H 0(填“>”、“<”或“=”)。
②可以判断该分解反应已经达到化学平衡的是____。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25.0℃时的分解平衡常数为 。
(2)25℃时,NH3.H2O电离常数Kb=1.8×10—5,Mg(OH)2的溶度积常数Ksp=1.8×10—11,用pH计测得0.5 mol/L氨水溶液的pH约为 。在某氯化镁溶液中加入一定量的某浓度的烧碱后,测得混合液pH =11.0,则此温度下残留在溶液中的c(Mg2+)=____。(已知lg2≈0.3、lg3≈0.5)。
实验室利用饱和NaNO2溶液(12mol/L)和NH4Cl溶液加热制备N2。
(1)若配制250 mL上述NaNO2溶液需要的玻璃仪器 ,可用 法收集N2。
(2)写出上述实验原理的离子方程式 并标出电子转移的数目和方向(单线桥法或双线桥法都可)
(3)NH4Cl溶液中加人镁粉也可以产生气体,写出相应的化学方程式
(4)向20 mL 0.01 mol/L的HNO2溶液中逐滴滴加相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液的体积的变化如图所示:(已知HNO2的电离平衡常数为K=4.6X10-4)则图中a点的c(H+)= ,b点溶液呈酸性的原因是(结合离子方程式表示) (已知 )。
)。

水溶液中的行为是中学化学的重要内容。
(1)25 ℃时,某溶液中由水电离出c(H+)=1×10-10 mol/L,该溶液pH为_______________。
(2)25 ℃时,测得亚硫酸氢钠溶液的pH<7,解释该溶液显酸性的原因(用离子方程式表示,并作适当解释) 。
(3)电离常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 |
电离常数(25 ℃) |
| HCN |
K=4.9×10-10 |
| HClO |
K=3×10-8 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
25 ℃时,将浓度相同的四种盐溶液:① NaCN ② NaClO ③ Na2CO3 ④ NaHCO3,按pH由大到小的顺序排列 (填序号),向84消毒液中通入少量的CO2,该反应的化学方程式为 。
(4)25 ℃时,将n mol·L-1的氨水与0.2mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_______________性(填“酸”、“碱”或“中”), NH3·H2O的电离常数Kb=_____________(用含n的代数式表示)。
碘溶于碘化钾溶液中形成I3—,并建立如下平衡:I3— I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
实验原理:
为了测定平衡时的c(I3—) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 =" 2NaI" + Na2S4O6。
由于溶液中存在I3— I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
实验内容:
1.用一只干燥的100 mL 碘量瓶和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
2.将两只碘量瓶塞好塞子,振荡30分钟,静置。
3.分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
4.带入数据计算c(I3—)
试回答下列问题
(1)标准Na2S2O3溶液应装入 (填“酸式滴定管”或“碱式滴定管”),原因是 。
(2)碘量瓶在震荡静置时要塞紧塞子,可能的原因是 。
(3)滴定时向待测液中加入的指示剂是 ,到达滴定终点时的现象为 。
(4)用c 、V1和V2表示c(I3—)为 mol·L-1。
(5)若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3—) (填“偏大”、“偏小”或“不变”) 。
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,
溶液中c(Na+) c(CH3COO-)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
二甲酸钾是一种白色晶体,商品名为弗米(Formil),是一种能替代抗生素的促生长剂,化学式为KH(HCOO)2,具有吸湿性,易溶于水。
二甲酸钾的生产工艺流程如下:
(1)写出甲酸和碳酸钾生产二甲酸钾的化学方程式: 。
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL。
①加入的指示剂是 (选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是 。
②上述弗米产品中二甲酸钾的质量分数为 。
常温下,0.1m01/L的下列溶液:
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl。
(1)pH由小到大排列顺序为 (填序号);
(2)实验室配制⑤的溶液时常需加入少量盐酸,否则得到的是浑浊的溶液,产生浑浊的原因是(用离子方程式表示)
(3)物质的量浓度相同的①氨水②氯化铵③碳酸氢铵④硫酸氢铵⑤硫酸铵
在上述五种溶液中,铵根离子物质的量浓度由大到小的顺序是
(4)已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、39l kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为