下列图像与对应的叙述相符的是
| A.图I表示盐酸滴加到0.1mol/L某碱溶液中得到的滴定曲线,有图I可知二者恰好中和时,所得溶液的pH=7 |
B.图II表示一定条件下进行的反应2SO2+O2 2SO3ΔH<0各成分的物质的量变化,t2时刻改变的条件可能是加压或降低温度 2SO3ΔH<0各成分的物质的量变化,t2时刻改变的条件可能是加压或降低温度 |
| C.图III表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mlBa(OH)2溶液时,沉淀是Al(OH)3和BaSO4的混合物 |
| D.图IV表示向一定体积含等浓度NH4Cl、AlCl3、MgCl2混合溶液中逐渐加入NaOH溶液至过量的过程中,生成沉淀的质量与加入NaOH溶液的体积之间的关系 |
室温下,用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示。下列说法不正确的是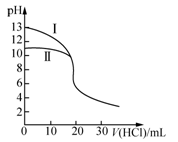
| A.Ⅱ表示的是滴定氨水的曲线,当V(HCI)=20 mL时,有:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B.当pH=7时,滴定氨水消耗的V(HCl)=20 mL,且c(NH4+)=c(Cl-) |
| C.滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(Na+)>c(H+)>c(OH-) |
| D.当滴定氨水消耗V(HCl)=10 mL时,有:2[c(OH-)-c(H+)]=c(NH4+)-c(NH3·H2O) |
已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+ H2O 2H++ 2CrO42-(黄色),①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。②向2 mL 0.1 mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+
2H++ 2CrO42-(黄色),①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。②向2 mL 0.1 mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+ 2Cr3+(绿色) + 6Fe3+ + 7H2O。下列分析正确的是
2Cr3+(绿色) + 6Fe3+ + 7H2O。下列分析正确的是
| A.实验①和②均能证明K2Cr2O7溶液中存在上述平衡 |
| B.实验②能说明氧化性:Cr2O72-> Fe3+ |
| C.CrO42-和Fe2+在酸性溶液中可以大量共存 |
| D.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示,则下列说法错误的是
| A.Q点消耗氨水溶液的体积等于HCl溶液的体积 |
| B.M点所示溶液导电能力弱于Q点 |
| C.M点和N点所示溶液中水的电离程度相同 |
| D.N点所示溶液中c(NH4+) > c(OH-) |
下列图示与对应的叙述相符的是:
A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH。
B.图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B﹥A。
C.图3表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应。
D.图4表示将1.000 mol/L氨水滴入20.00mL1.000 mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线
25℃时,取浓度均为0.1000mol·L-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol·L-1NaOH溶液、0.1000mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如下图所示。下列说法不正确的是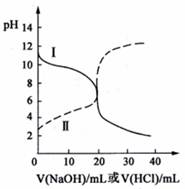
| A.根据滴定曲线可得,25℃时Ka(CH3COOH)≈Kb(NH3·H2O)≈10-5 |
| B.当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和曲线Ⅱ刚好相交 |
| C.曲线Ⅱ:滴加溶液至10.00mL时,溶液中c(CH3COO-) + c(OH-)>c(CH3COOH) + c(H+) |
| D.在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小 |
【改编】室温时,向20 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确的是
| A.pH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.当V(NaOH)=20mL时,溶液中水的电离程度比纯水大 |
| C.当V(NaOH)=30mL时,溶液中 c(SO42-)+ c(H+)=c(NH3·H2O) + c(OH-) |
| D.滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol·L-1 |
常温下,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。有关微粒的物质的量变化如下图(其中)Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,根据图示判断,下列说法正确的是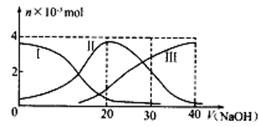
A.H2A在水中的电离方程式是:H2A=H++HA-;HA- H++A2-
H++A2-
B.当V(NaOH)=20mL时,溶液中各粒子浓度大小顺序为:c(Na+)> c(HA-) >c(H+) > c(A2-)>c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
D.当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+) + c(HA-)+ 2c(H2A) = c(A2-) + 2c(OH-)
常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是
A.HA溶液加水稀释后,溶液中 的值减小 的值减小 |
B.HA的电离常数 (x为滴定分数) (x为滴定分数) |
| C.当滴定分数为100时,溶液中水的电离程度最大 |
| D.滴定分数大于100时,溶液中离子浓度关系一定是c(Na+)>c(A-)>c(OH-)>c(H+) |
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)  Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O  HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO  H+ + ClO- Ka=?
H+ + ClO- Ka=?
其中,Cl2(aq)、HClO和ClO-分别在三者中所占的物质的量分数(α)随pH变化的关系如图所示。下列表述正确的是
A.Cl2(g)+ H2O  2H+ + ClO-+ Cl- K=10-10.9 2H+ + ClO-+ Cl- K=10-10.9 |
| B.pH=7.5时,用氯处理饮用水体系中,c(Cl-) + c(HClO) =c(H+)-c(OH-) |
| C.用氯处理饮用水时,pH=6.5时杀菌效果比pH=4.5时好 |
| D.氯处理饮用水时,在夏季的杀菌效果比在冬季好 |
下列各表述与示意图一致的是( )
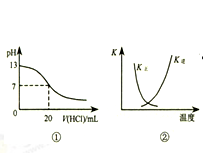
| A.图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| B.图②中曲线表示反应2SO2(g)+O2(g)⇌2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 |
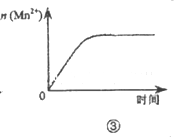
| C.图③表示10 mL 0.0l mol•L-1KMnO4酸性溶液与过量的0.1 mol•L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化 |
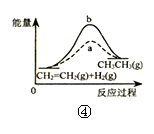
| D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化 |
下列说法正确的是( )
| A.c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 |
| B.室温下,水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 |
| C.相同温度下,等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为②>④>③>① |
| D.往0.1mol/LCH3COOH溶液中通入少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中c(CH3COOH)/c(H+)·c(CH3COO-) 增大 |
室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH)。下列判断正确的是( )
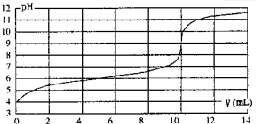
| A.HA的浓度为1×10-4mol•L-1 | B.实验时可选甲基橙作指示剂 |
| C.pH=7时,溶液中c(Na+)>c(A-) | D.V=10mL,酸碱恰好中和 |
常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液,所得滴定曲线如图所示.下列说法正确的是( )

| A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
| B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) |
| C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.0.1mol·L-1NaHCO3溶液中的粒子浓度:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)>c(H+)
B.将标况下2.24L的CO2通入150mL 1mol·L-1NaOH溶液中充分反应后的溶液:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+)
D.0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+2c(A-)=c(H+)+2c(HA)