下列液体均处于25℃,有关叙述正确的是
| A.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| C.某溶液中由水电离出来的c(H+)和c(OH—)的乘积为1×10—24,该溶液中一定可以大量存在K+、Na+、[Al(OH)4]—、SO42— |
| D.常温下0.1 mol·L—1 HA溶液的pH>1,0.1 mol·L—1 BOH溶液中c(H+)/c(OH—)=10—12,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为:c(B+)>c(OH—)>c(H+)>c(A—) |
【改编】含有一定量NaOH溶液中,逐渐通入一定量CO2,充分反应后,将溶液在一定条件下进行低温蒸干,得到晶体物质。其质量m 与通入气体体积V(CO2)的关系如图。如下说法正确的是
| A.整个过程中的溶液,一定存在恒等式:]c(Na+)+c(H+)=c(OH-)+c(CO32-)+c(HCO3-) |
| B.晶体物质:a点是NaOH,b点是Na2CO3 |
| C.c点的溶液中存在c(OH-)-c(CO32-)= c(H+)+c(H2CO3) |
| D.若通入V2="1.344" L (标况)气体,则m2="13.12" g |
已知90℃时,Kw = 1.0´10-12,在90℃将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得溶液pH=7,则NaOH溶液与硫酸溶液的体积比为
| A.1:9 | B.9:1 | C.10:1 | D.1:10 |
【改编】下列叙述正确的是
| A.常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
| B.常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小 |
| C.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl) |
| D.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
【改编】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是
| A.HA一定为一元强酸 |
| B.若x>50,则MOH为一元弱碱 |
| C.N点溶液中:c(A-)=c(M+)>c(OH—)=c(H+) |
| D.若K点对应的溶液的pH=12,则K点溶液中水的电离程度大于0.01 mol·L-1HA溶液中水的电离程度 |
下列关于常温下电解质溶液的叙述中,正确的是
A.碳酸氢铵溶液和足量氢氧化钠溶液混合的离子反应: |
| B.向一定体积一定物质的量浓度的氨水中滴加盐酸,所得溶液一定存在:c(H+)+c(NH4+)=c(Cl‾)+c(OH‾) |
| C.标准状况下4.48L二氧化碳气体通入到2L0.15mol•L‾1的NaOH溶液中,离子浓度大小顺序为:c(Na+) > c(CO32‾) > c(OH‾) >c(HCO3‾) > c(H+) |
| D.pH=8的0.1 mol·L-l CH3COONa溶液中由水电离出的c(OH‾)=1.0×10-8mol•L‾1 |
下列有关溶液中粒子浓度的关系式中,正确的是
A.pH相同的①CH3COONa、②NaHCO3、③  三份溶液中的c(Na+):③>②>①
三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中: c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.右图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.右图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/c( )的值保持增大
)的值保持增大
②浓度均为0.1mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c( )+c(
)+c( )]
)]
③在0.1mol·L-1氨水中滴加0.1mol·L-1盐酸,恰好完全反应时溶液的pH=a,则由水电离产生的c(OH-)=10-a mol·L-1
④向0.1mol·L-1(NH4)2SO3溶液中加入少量NaOH固体,c(Na+)、c( )、c(
)、c( )均增大
)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+2c(H2S)+c(HS-)
| A.①④ | B.②④ | C.①③ | D.②⑤ |
室温时,将0.10 mol/L的NaOH溶液滴入20.0 mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图。下列有关说法不正确的是
| A.该一元酸溶液浓度为0.10mol/L |
| B.a、b、c点的水溶液导电性依次增强 |
C.室温时,HA的电离常数Ka l×10-5 l×10-5 |
| D.a点和c点所示溶液中H2O的电离程度相同 |
下列说法正确的是:
A.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,
则a、b、c的大小关系是:b>c>a
B.常温下5.0×10-3mol·L-1KHA溶液的pH=3.75,该溶液中c(A2-)< c(H2A)
C.室温时,M(OH)2(s)  M2+(aq)+2OH-(aq) Ksp=a; c(M2+)="b" mol·L-1时,溶液的pH等于14+
M2+(aq)+2OH-(aq) Ksp=a; c(M2+)="b" mol·L-1时,溶液的pH等于14+ 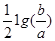
D.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
将CO2慢慢通入一定体积的NaOH溶液中,溶液的pH随CO2体积(标准状况下)的变化曲线如图所示,则下列说法中正确的是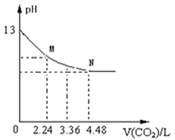
| A.NaOH溶液的物质的量浓度为0.1 mol/L,体积为1 L。 |
| B.M、N点离子浓度的都是c(HCO3-)>c(CO32-)。 |
| C.V=3.36 L时,溶液中的离子浓度关系是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。 |
| D.曲线上任意点都符合:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)。 |
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
| A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为H2A=HA-+H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |
常温下,下列叙述错误的是
A.向0.1 mol·L-1的醋酸溶液中加水或通入HCl气体都能使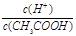 值增大 值增大 |
| B.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) |
| C.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 |
D.0.1 mol·L-1某一元酸HA溶液中 =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol·L-1 =1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol·L-1 |
常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列叙述的判断正确的是 ( )
| A.甲中水电离出来的H+ 的物质的量浓度是乙中水电离出来的H+ 的物质的量浓度的10倍 |
| B.中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,10V(甲)=V(乙) |
| C.物质的量浓度c(甲)>10c(乙) |
| D.甲中的c(OH-)为乙中的c(OH-)的10倍 |
常温下,向 20 mL 0.1 mol·L-1CH3COOH溶液中滴加0.1 mol·L-1NaOH溶液。下列说法正确的是
| A.当溶液的pH=7时:c(Na+) = c(CH3COO-) + c(CH3COOH) |
| B.当加入10 mL 0.1 mol·L-1NaOH溶液时:c(CH3COO-) +2 c(OH-) = c(CH3COOH) + 2c(H+) |
| C.当加入20 mL 0.1 mol·L-1NaOH溶液时:c(Na+) >c(OH-) >c(CH3COO-) > c(H+) |
| D.滴定过程中可能有:c(CH3COOH) >c(H+) >c(CH3COO-) >c(Na+) >c(OH-) |