期中备考总动员高三化学模拟卷【浙江】5
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。下列说法不正确的是
| A.生产水泥的原料是大理石、纯碱、石英,其组成一般为Na2O·CaO·6SiO2 |
| B.Si与NaOH溶液反应的离子方程式为:Si+2OH-+H2O =SiO32-+2H2↑ |
| C.焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是CO2 |
| D.经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4g固体;则此熔渣中Al2O3的质量分数为25% |
【原创】下列说法正确的是
| A.过滤时漏斗下端与烧杯内壁要保持接触,分液时分液漏斗下端与锥形瓶(或烧杯)内壁不能接触 |
| B.受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 |
| C.比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]溶液,观察铁钉周围出现蓝色沉淀的快慢 |
| D.自来水厂常用某些含铝或铁的化合物作净水剂,是由于这些物质具有杀菌消毒作用 |
【改编】香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的最外层电子数与次外层的相等,X、Z位于同主族,Y、Z、R、T位同周期,最外层电子数为次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是
| A.原子半径:Y>Z>R>T | B.气态氢化物的稳定性:W<R<T |
| C.最高价氧化物对应水化物的碱性:X>Z | D.化合物XR2、WR2所含化学键的类型相同 |
下列说法正确的是
A.按系统命名法,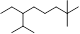 的名称为2,7,7―三甲基―3―乙基辛烷 的名称为2,7,7―三甲基―3―乙基辛烷 |
B.实验证实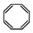 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 |
C.DDT的结构简式为 ,分子中最多有14个碳原子共平面 ,分子中最多有14个碳原子共平面 |
D.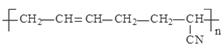 的单体是CH3―C≡C―CH3和CH2=CH―CN 的单体是CH3―C≡C―CH3和CH2=CH―CN |
【改编】用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示(a、b为铜电极)。下列说法中不正确的是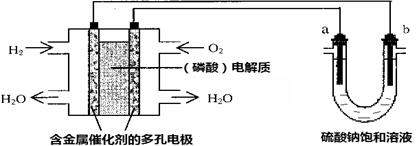
| A.电池工作时,正极反应式为:O2 + 4H++ 4e-= 2H2O |
B.电解时,当阴极逸出a mol气体,同时有W克Na2SO4•10H2O 析出,保持温度不变,剩余溶液中的硫酸钠的质量分数是 |
| C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D.忽略能量损耗,当电池中消耗0.01g O2 时,b 极周围会产生0.02g H2 |
【改编】室温时,向20 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确的是
| A.pH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.当V(NaOH)=20mL时,溶液中水的电离程度比纯水大 |
| C.当V(NaOH)=30mL时,溶液中 c(SO42-)+ c(H+)=c(NH3·H2O) + c(OH-) |
| D.滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol·L-1 |
固体粉末X中可能含有Fe、Fe2O3、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下:
根据上述实验,以下说法正确的是
| A.气体A一定只是NO |
| B.由于在溶液A中加入BaCl2溶液有沉淀产生,因此可以判断溶液甲中含有K2SO3 |
| C.若向固体甲中加入足量浓盐酸,再加KSCN溶液,没有血红色,则证明原混合物中一定没有Fe2O3 |
| D.溶液甲中一定含有K2SiO3、可能含有KAlO2、MgCl2 |
(10分)某科研小组利用石油分馏产品经下列路线,合成一种新型香料。

已知X分子中碳氢质量比为24∶5,A、E都是X的裂解产物,且二者互为同系物,D与饱和NaHCO3溶液反应产生气体。
信息提示:卤代烃在强碱水溶液中发生水解(取代)反应生成醇。如:
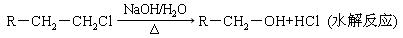
(1)X分子为直链结构,X的名称为 ;C中官能团的名称为 。
(2)①~⑥的反应中,下列反应类型存在且数目由多到少的是 。(用字母和“>”写出)
A.加成反应 B.加聚反应 C.取代反应 D.氧化反应
(3)B与D在浓硫酸作用下,生成甲,则与甲同类别的同分异构体的有 种(不包括甲)
(4)写出⑥的化学反应方程式 。
(5)E可能发生下列选项中的某种反应,写出能反应的化学方程式 。
A.皂化反应 B.与乙酸的酯化反应
C.加聚反应 D.与银氨溶液的银镜反应
【原创】(18分)甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系。根据要求回答下列问题:
I.已知:甲是由两种短周期元素组成的化合物,丙的水溶液显碱性。
(1)若构成甲的阴、阳离子个数比为2:3,丙是气体。则构成甲的阴、阳离子半径大小关系为 (用具体的微粒表示)。
(2)若乙是O2,则甲的一种重要用途是 ;产物丙与Cl2按2:1(物质的量)反应得到丁溶液,丁溶液中阴离子浓度从大到小的顺序是 。
Ⅱ.一种灰白色固体粉末X是由两种常见元素组成的化合物,其中金属元素与另一元素的质量比为14:l。在一定条件下X可发生如下图的转化关系,有的反应标出全部产物,有的反应标出部分产物。已知P为混合气体,R是无色无味能使澄清石灰水变浑浊的气体,C为红褐色物质,M为常见金属单质,Q为常见非金属单质。请回答下列问题:

(1)X的化学式为______________;R的电子式为_________________。
(2)写出气体P的组成 。
(3)写出D→G的离子反应方程式 。
(4)M与钛构成的合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、M3+溶液中加入M至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+==2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O ="=" TiO2+(无色)+Fe2++2H+
③ 。
请写出③可能的反应方程式 。
(5)人们对X的结构研究后发现其金属元素有0价、+2价两种化合价,写出X与稀硫酸反应的化学方程式 。
(6)聚合硫酸M是一种常见的净水剂,化学式为:[M2(OH)n (SO4)3- ]m (n>2,m≤10),其制备可由硫酸M经水解后再聚合得到,其中聚合反应的原理为m[M2(OH)n(SO4)3-
]m (n>2,m≤10),其制备可由硫酸M经水解后再聚合得到,其中聚合反应的原理为m[M2(OH)n(SO4)3- ]
]  [M2(OH)n(SO4)3-
[M2(OH)n(SO4)3- ]m,则写出硫酸M水解的化学方程式为 。
]m,则写出硫酸M水解的化学方程式为 。
【命题立意】本题综合考查元素及其化合物的知识,融入信息型化学方程式的书写,旨在考查考生知识迁移能力以及应用化学原理解决实际问题的能力。
【改编】(15分)硫代硫酸钠俗称“海波”,又名“大苏打”,具有较强的还原性和配位能力,是冲洗照相底片的定影剂,棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图(a)所示。
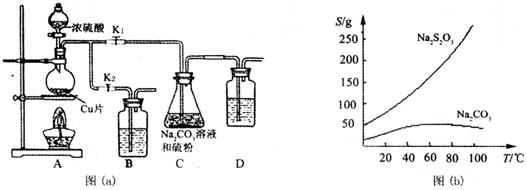
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图(b)所示。
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后,检查A、C装置气密性的操作是 。
步骤2:加入药品,打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。写出烧瓶内发生反应的化学方程式 。装置B、D的作用是 。
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH 时,打开K2、关闭K1并停止加热;C中溶液要控制pH的理由是 。
步骤4:过滤C中的混合液,将滤液经过 、 、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:
向足量的新制氯水中滴加Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性。该方案是否正确并说明理由 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42—全部转化为Cr2O72—;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L—1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为:
①Cr2O72— + 6I—+ 14H+ ="=" 2Cr3+ + 3I2 + 7H2O;
②I2 + 2S2O32— ="=" 2I—+ S4O62—
则该废水中Ba2+的物质的量浓度为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号