下列说法不正确的是( )
A.已知氢气的燃烧热为285.8kJ/mol,相应的热化学方程式为H2(g)+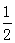 O2(g)=H2O(g),△H="-285.8" kJ/mol O2(g)=H2O(g),△H="-285.8" kJ/mol |
| B.中和相同体积、相同物质的量浓度的①硫酸,②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 |
| C.稀氨水中部分粒子的浓度大小关系:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+) |
| D.1mol/LNaX和1mol/LNaY两种盐溶液中c(X-)=c(Y-)+c(HY),则HX为强酸 |
某温度下,水的离子积约为10-12,将Va L pH=2的硫酸溶液与Vb L pH=11的NaOH溶液混合,若混合溶液的pH=10,体积是(Va+Vb) L,则Va∶Vb为( )
| A.2∶11 | B.11∶2 | C.9∶2 | D.2∶9 |
用0.1000mol·L-1标准NaOH溶液测定食醋中醋酸的含量,下列说法正确的是( )
| A.酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2~3次 |
| B.应该选择酚酞作指示剂 |
| C.滴定过程中眼睛应始终注视滴定管内液面变化 |
| D.读取标准液的刻度时,滴定前平视,滴定后仰视,测定结果偏低 |
常温下,关于pH = 2的盐酸,下列说法不正确的是
| A.溶液中c(H+) = 1.0×10-2 mol·L-1 |
| B.此溶液中由水电离出的c(OH-) = 1.0×10-12 mol·L-1 |
| C.加水稀释100倍后,溶液的pH = 4 |
| D.加入等体积pH = 12的氨水,溶液呈中性 |
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是
| A.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 |
| B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 |
| C.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 |
| D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2是1.2×10-2。下列说法正确的是( )
| A.H2SeO3和H2SeO4第一步电离程度大于第二部电离的最主要原因是第一步电离出的氢离子对第二步电离有抑制作用 |
| B.同浓度的H2SeO4的酸性强于硫酸 |
| C.H2SeO3和H2SeO4的非羟基氧分别为3和4 |
| D.H2SeO4中Se原子的杂化方式为sp3 |
己知lg2="0.3" ,lg5 =" 0.7" ,某温度(t℃)时,测得0.0lmol/L的NaOH溶液的pH="11" 。在此温度下,将60mLpH=1的H2SO4溶液与40mL0.1mol/L的Ba(OH)2溶液混合(忽略溶液混合体积的变化),所得溶液的pH为( )
| A.12.3 | B.11.7 | C.11.3 | D.12.7 |
常温下,向20mL的某稀H2SO4溶液中滴入0. 1mol/L氨水,溶液中水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是
A.稀硫酸的浓度为0.1mol/L
B.C点溶液pH=14-a
C.E溶液中存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D.B到D、D到F所加氨水体积一定相等
常温下,0.1mol/L的下列溶液中,水的电离程度大小排列顺序正确的是( )
①AlCl3 ②KNO3 ③NaOH ④NH3·H2O
| A.①>②>③>④ | B.①>②>④>③ | C.③>④>②>① | D.①=②=③=④ |
25℃时,将某一元酸HA和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表,下列判断不正确的是( )

A.X>0.05
B.将实验①所得溶液加水稀释后,c(OHˉ )/c(A-)变大
C.实验①所得溶液c(A-)+c(HA)=0.10mol·L-1
D.实验②所得溶液: c(Na+)+c(OH-)= c(A-)+c(H+)
已知醋酸、醋酸根离子在溶液中存在下列平衡:
| CH3COOH+H2O |
C H3COO-+H3O+ |
K1=1.75×10-5 mol·L-1 |
| CH3COO-+H2O |
CH3COOH+OH- |
K2=5.71×10-10 mol·L-1 |


 现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
A.溶液甲的pH>7
B.对溶液甲进行微热,K1、K2 同时增大
C.若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大
D.若在溶液甲中加入 5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的 K1 会变大
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,错误的是( )

用己知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确是
| A.滴定前,没有逐出滴定管下口的气泡 |
| B.用甲基橙作指示剂,指示剂刚变色,就停止滴定 |
| C.酸式滴定管用蒸馏水洗净后,直接加入己知浓度的盐酸 |
| D.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
某学生的实验报告所列出的下列数据中合理的是( )
| A.用1mol的醋酸溶液和1.01mol的氢氧化钠溶液做中和热实验测得中和热的数值为57.3kJ/mol |
| B.通过实验得知在常温常压下,12g固体C和32g气体O2所具有的总能量一定大于44g气体CO2所具有的总能量 |
| C.室温下,用广泛pH试纸测得某溶液的pH为2.3 |
| D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.7mL |