河北省张家口市高二上学期期末考试化学试卷
下列各物质的颜色变化不是由平衡移动引起的是( )
| A.H2、I2、HI平衡混合气体加压颜色变深 |
| B.氯水光照颜色变浅 |
| C.NO2、N2O4混合气体加热颜色变深 |
| D.FeCl3和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
常温下,0.1mol/L的下列溶液中,水的电离程度大小排列顺序正确的是( )
①AlCl3 ②KNO3 ③NaOH ④NH3·H2O
| A.①>②>③>④ | B.①>②>④>③ | C.③>④>②>① | D.①=②=③=④ |
下列说法中正确的是( )
| A.在Na3PO4溶液中,c(Na+)是c(PO43-)的3倍 |
| B.pH=3的盐酸中,其c(H+)是pH=1的盐酸中的c(H+)的3倍 |
| C.0.1mol/LKOH溶液和0.1mol/L氨水中,其c(OH-)相等 |
| D.在25℃时,无论酸性、中性还是碱性溶液中,其c(H+)和c(OH-)的乘积都等于1×10-14 |
反应:2H2(g)+O2(g)=2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是( )

| A.△H1<0 | B.△H2为该反应的反应热 |
| C.△H3不是H2的燃烧热 | D.△H3=△H1+△H2 |
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%。用于净化汽车尾气的反应为2NO(g)+2CO(g) 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢。下列说法正确的是( )

| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的常用方法是升高温度 |
| C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 |
| D.提高尾气净化效率的最佳途径是使用高效催化剂 |
对可逆反应A(g)+2B(g) 3C(g),在其他条件不变的情况下,下列有关叙述不正确的是( )
3C(g),在其他条件不变的情况下,下列有关叙述不正确的是( )
A.单位时间内消耗amol(A),同时消耗3amolC时,反应处于平衡状态
B.增大容器的体积,化学平衡不移动,反应速率也不变
C.升高温度使c(B)增大,可知正反应为放热反应
D.加入催化剂,改变了反应历程,但反应的△H不会变
氯化铁和硫氰化钾在溶液中存在下列平衡:Fe3+(aq)+3SCN-(aq) Fe(SCN)3(aq),某氯化铁和硫氰化钾的混合溶液中,Fe(SCN)3的物质的量浓度与温度T的关系如图所示(曲线上任何一点都表示平衡状态),下列说法不正确的是( )
Fe(SCN)3(aq),某氯化铁和硫氰化钾的混合溶液中,Fe(SCN)3的物质的量浓度与温度T的关系如图所示(曲线上任何一点都表示平衡状态),下列说法不正确的是( )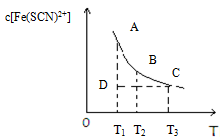
| A.FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为:Fe3+(aq)+SCN-(aq)=Fe(SCN)2+(aq) △H>0 |
| B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2 |
| C.反应处于D点时,一定有V正>V逆 |
| D.A点与B点相比,A点的c(Fe3+)大 |
已知水的电离平衡曲线如图所示,下列说法正确的是( )
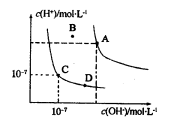
A.水的离子积常数关系为:Kw(B)>Kw(A)>Kw(C)>Kw(D)
B.保持温度不变,向水中加入醋酸钠固体,可从C点到D点
C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH="7"
D.温度升高可实现由C点到D点
下列说法不正确的是( )
A.已知氢气的燃烧热为285.8kJ/mol,相应的热化学方程式为H2(g)+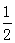 O2(g)=H2O(g),△H="-285.8" kJ/mol O2(g)=H2O(g),△H="-285.8" kJ/mol |
| B.中和相同体积、相同物质的量浓度的①硫酸,②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 |
| C.稀氨水中部分粒子的浓度大小关系:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+) |
| D.1mol/LNaX和1mol/LNaY两种盐溶液中c(X-)=c(Y-)+c(HY),则HX为强酸 |
某小组为研究金属的腐蚀与防护,设计如图所示装置。下列叙述不正确的是( )
| A.若X为碳棒,为减缓铁的腐蚀,开关K应置于N处 |
| B.若X为碳棒,开关K置于M处,会加快铁的腐蚀 |
| C.若X为锌,开关K置于M处,就是牺牲阳极的阴极保护法 |
| D.若X为锌,开关K置于N处,铁电极发生的反应为Fe-2e-=Fe3+ |
在某恒容密闭容器中进行如下可逆反应:2M(g)+N(g) W(?)+4Q(g)△H<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
W(?)+4Q(g)△H<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
A. |
B. |
C. |
D. |
对于化学反应方向的确定不仅与焓变(△H)有关,也与温度(T)、熵变(△S)有关,实验证明,化学反应的方向应由△H-T△S确定,若△H-T△S<0则自发进行,否则不能自发进行,下列说法中,正确的是( )
| A.在温度、压力一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
| B.温度、压力一定时,放热的熵增加反应不一定能自发进行 |
| C.反应焓变是决定反应能否自发进行的唯一因素 |
| D.固体的溶解过程只与焓变有关 |
99℃时,Kw=1.0×10-12,该温度下测得0.1mol/LNa2A溶液的pH=6。下列说法不正确的是( )
| A.H2A在水溶液中的电离方程式为H2A=2H++A2- |
| B.该温度下,将0.01mol/L的H2A溶液稀释20倍后溶液的pH=3 |
| C.体积相同,pH均为1的盐酸和H2A溶液分别与足量的Zn反应,产生H2较多的是H2A |
| D.将0.1mol/L的H2A溶液与0.2mol/L的氨水等体积混合后,溶液中浓度最大的离子是NH4+ |
已知图一表示的是可逆反应CO(g)+H2(g) C(s)+H2O(g)△H>0的化学反应速率与实践的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g)△H>0的化学反应速率与实践的关系,图二表示的是可逆反应2NO2(g) N2O4(g) △H<0的浓度随时间的变化情况。下列说法中正确的是( )
N2O4(g) △H<0的浓度随时间的变化情况。下列说法中正确的是( )
| A.图一t2时改变的条件可能是升高了温度或增大了压强 |
| B.图一t2时改变的条件一定是增大了反应物的浓度 |
| C.图二t1时改变的条件可能是升高了温度或增大了压强 |
| D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
有关下列装置的叙述不正确的是( )
① ②
② ③
③ ④
④
| A.图①铝片发生的电极反应式是:Al+4OH--3e-=AlO2-+2H2O |
| B.图②发生析氢腐蚀,离子反应方程式为:Fe+2H+=Fe2++H2↑ |
| C.图③溶液中发生了变化:4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.图④充电时,阳极反应是:PbSO4+2H2O-2e-=PbO2+SO42-+4H+ |
已知碳酸氢钾溶液显碱性,25℃时向10mL0.01mol/LKHCO3溶液中滴加0.01mol/LKOH溶液,随着KOH溶液体积的增加,溶液中微粒浓度关系正确的是( )
| A.V(KOH)=0时,溶液中c(K+)=c(HCO3-)+c(H2CO3) |
| B.V(KOH)=10mL时,溶液中c(HCO3-)>c(H2CO3) |
| C.V(KOH)=20mL时,溶液中c(K+)>c(CO32-)>c(OH-)>c(H+) |
| D.对V(KOH)=10mL时的溶液升温,溶液中:c(K+)>c(OH-)>c(CO32-)>c(H+) |
下列说法正确的是( )
| A.常温下将pH=2的硫酸和pH=12的MOH溶液等体积混合,所得溶液pH≤7 |
| B.已知同温度相同浓度的NaNO2溶液比NaF溶液的碱性强,所以氢氟酸的酸性比亚硝酸的弱 |
| C.常温下,将醋酸钠、盐酸两溶液混合后,溶液呈中性,则有c(Na+)>c(Cl-)=c(CH3COOH) |
| D.pH相等的NH4Cl、(NH4)2SO4、NH4HSO4三种溶液物质的量浓度为c(NH4Cl)>c((NH4)2SO4)=c(NH4HSO4) |
已知25℃时:①H+(aq)+OH-(aq)=H2O(l) △H1=-57.3kJ/mol
②HF(aq)+OH-(aq)=F-(aq)+H2O(l) △H2=-67.7kJ/mol
③Ba2+(aq)+SO42-(aq)=BaSO4(s) △H3<0
下列说法正确的是( )
| A.△H1=-57.3kJ/mol是强酸和强碱在稀溶液中反应生成可溶性盐的中和热 |
| B.在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 |
C.HF的电离方程式及热效应:HF(aq) H+(aq)+F-(aq)△H>0 H+(aq)+F-(aq)△H>0 |
| D.稀硫酸与稀氢氧化钡溶液反应的热化学方程式为 |
H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) △H=-114.6kJ/mol
已知反应2NO2(g)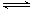 N2O4(g) △H<0,在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
N2O4(g) △H<0,在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
|
|
0.08 |
0.08 |
下列分析合理的是( )
A.从反应开始直至60s和80s时,二氧化氮的平均反应速率是相等的
B.80s后将容器的体积缩小为1L,平衡向正反应方向移动,气体颜色变浅
C.n1的范围是0.28<n1<0.33
D.升高温度,既能加快反应速率,也能提高N2O4的体积分数
硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥及朱红雕刻漆器等。某温度时HgS在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
| A.向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小 |
| B.图中a点对应的是饱和溶液 |
| C.向c点的溶液中加入0.1mol/LHg(NO3)2,则c(S2-)减小 |
| D.升高温度可以实现c点到b点的转化 |
有效利用现有资源是解决能源问题的一种实际途径,发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:

(1)以CO和CO2分别与H2为原料,在一定条件下均可合成甲醇(CH3OH)。你认为用哪种合成设计路线更符合“绿色化学”理念:(用化学反应方程式表示)____________;
(2)下图表示在恒容容器中230℃催化剂条件下,0.5molCO2和1.5molH2反应得到甲醇蒸气,产率达80%时的能量变化示意图。

①写出该反应的热化学方程式:_____________________。
②能判断该反应达到化学平衡状态的依据是_____________________。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中气体密度不变
(3)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:负极______。

(4)“催化还原”反应制乙二醇(HOCH2-CH2OH)原理如下:
CH3OOC-COOCH3(g)+4H2(g) HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究,下图表示乙二醇达平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线丙对应的压强时P(丙)=___________。

(5)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸。H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示曲线①代表的粒子是___________;草酸氢钾溶液中存在如下平衡:H2O H++OH-,HC2O4-
H++OH-,HC2O4- H++C2O42-和___________;一定温度下,往CaC2O4饱和溶液[已知Ksp(CaC2O4=2.3×10-9)]中加入少量CaCl2固体,c(Ca2+)将_________,CaC2O4的溶解度将____________。(填“增大”“减小”或“不变”)
H++C2O42-和___________;一定温度下,往CaC2O4饱和溶液[已知Ksp(CaC2O4=2.3×10-9)]中加入少量CaCl2固体,c(Ca2+)将_________,CaC2O4的溶解度将____________。(填“增大”“减小”或“不变”)

铁是用途最广泛的金属材料之一,但生铁易生锈,请讨论电化学实验中有关铁的性质。
(1)某原电池装置如图所示,右侧烧杯中的电极反应为_________,左侧烧杯中的c(Cl-)________(填“增大”“减小”或“不变”)。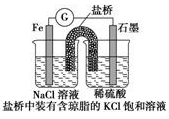
(2)已知下图甲、乙两池的总反应式均为Fe+H2SO4=FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料(填“Fe”或“C”)。
(3)用高铁酸盐设计的高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。
①写出正极电极反应式________________________________。
②用高铁电池做电源,以铁为阳极,以铜作阴极,对足量KOH溶液进行电解,当电池中有0.2molK2FeO4反应时,则在电解池中生成H2________L。(标准状况)
铁可以形成多种氧化物、氢氧化物和盐类。铁与二氧化碳、水在某一密闭体系中反应情况如下表所示:
| 化学反应 |
平衡常数 |
温度 |
|
| 973K |
1173K |
||
| ⅠFe(s)+CO2(g)= FeO(s)+CO(g) |
K1 |
1.47 |
2.15 |
| ⅡFe(s)+H2O(g)= FeO(s)+H2(g) |
K2 |
2.38 |
1.67 |
| ⅢCO(g)+H2O(g)= CO2(g)+H2(g) |
K3 |
? |
? |
完成下列填空:
(1)反应Ⅰ是________(选填“吸热”,“放热”)反应。根据反应Ⅰ与Ⅱ可以推导出同温下K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(2)973K时,若反应Ⅲ在一个容积为2L的反应容器内2min时达到平衡,有3mol电子发生转移,则在2min内v(CO2)=__________。若压缩容器的容积为原来的一半,平衡将________移动(选填“向左”,“向右”,“不”),CO2的浓度将________(选填“增大”,“减小”,“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有________。
按要求回答下列问题:
(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为________________。
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是______________。
A.溶液中导电粒子的数目减小
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中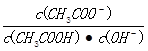 不变
不变
D.溶液中 减小
减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=______________________(溶液体积变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如表所示:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
①根据表中数据,将浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是____。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是_____________。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+CO2+H2O
(5)几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]___________Ksp[Mg(OH)2](填“>”、“=”或“<”)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号