有关物质的转化关系如下图所示(部分物质和条件已略去)。A、D是常见金属,B、C是它们的氧化物,B是红棕色固体,D是年产量最高的金属,I、J是氯碱工业的主要产品,H是一种常见强酸,可由氯碱工业的产品为原料制得。请回答下列问题:

(1) B的化学式为 。
(2) H的电子式为 。
(3) 写出E与I反应的离子方程式: 。
(4) 写出A与J反应的化学方程式: 。
下列离子方程式书写正确的是
A.Na2S溶液的水解:S2-+ 2H2O H2S + 2OH- H2S + 2OH- |
B.NaHCO3溶液的电离:HCO3-+ H2O H2 CO3+ OH- H2 CO3+ OH- |
C.NH4Cl溶液的水解:NH4+ + H2O NH3·H2O + H+ NH3·H2O + H+ |
| D.泡沫灭火器灭火原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ |
金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
(1)工业上处理酸性含Cr2O72-废水的方法如下:
①向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式: 。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为 。
(2)铬元素总浓度的测定:准确移取25.00mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015mol/L的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL。计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。
已知测定过程中发生的反应如下:
①2Cr3+ + 3S2O82-+ 7H2O=Cr2O72-+ 6SO42-+ 14H+
②Cr2O72-+ 6I-+ 14H+=2Cr3+ + 3I2 + 7H2O
③I2 + 2S2O32-=2I-+ S4O62-
解释下列事实的离子方程式不正确的是
| A.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-=SiO32-+H2O |
| B.用大理石与稀盐酸制备CO2:CaCO3+2H+=Ca2++CO2↑+H2O |
| C.稀H2SO4与BaCl2溶液反应生成沉淀:Ba2++SO42-=BaSO4↓ |
| D.Cu与浓H2SO4反应放出气体:Cu+2H+=Cu2++H2↑ |
下列离子方程式错误的是
| A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++ SO42-=BaS04↓+2H2O |
| B.酸性介质中KMnO4氧化H2O2:2MnO4- +5H2O2+6H+=2Mn2++5O2↑+ 8H2O |
| C.等物质的量的MgCl2、Ba(OH)2和HC1 溶液混合:Mg2++2OH-=Mg(OH)2↓ |
| D.铁铜原电池(稀硫酸做电解质)放电时的负极反应:Fe-2e-=Fe2+ |
已知A是用途最广泛的金属单质,B是常温下呈液态的化合物,E是一种黄绿色的气体。(图中部分产物未标出)。

回答下列问题:
(1)写出F的化学式 。
(2)写出下列反应的化学反应方程式:
反应① ;
反应⑧ 。
(3)写出反应③的离子方程式: 。
(4)鉴别G溶液中阳离子的方法 。
(5)将H溶液滴加到沸水中,继续加热煮沸,得到的液体颜色为 。
下列实验现象及相关的离子方程式均正确的是
| A.Cl2与FeI2溶液反应,当n(C12):n(FeI2)=1:1时,2Fe2++2I-+2C12=2Fe3++I2 +4C1- |
| B.向Ba(NO3)2溶液中通人SO2气体,出现白色沉淀:Ba2++SO2+H2O=BaSO3↓+2H+ |
| C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色:2MnO4-+7 H2O2+6H+=2Mn2++6O2↑+10 H2O |
D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合:Ba2++SO +H++OH-=aSO4↓+H2O +H++OH-=aSO4↓+H2O |
碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸氢钠的化学式是___________,俗称____________,其水溶液显_______性(填“酸”、“碱”或“中”)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为_____________。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者_________后者(填“>”、“<”或“=”)。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为__________________________。
下列反应的离子方程式正确的是
A 硫酸铜溶液与氢氧化钡溶液反应: Ba2++SO42-=BaSO4↓
B 向三氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=A1(OH)3↓+3NH4+
C 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH—=CaCO3↓+H2O
D 石灰石溶于醋酸: CaCO3+2H+=Ca2++CO2↑+H2O
(1)FeCl3溶液呈________(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_______________________;实验室在配制FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中,_____________(填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(2)将氯化铝溶液蒸干灼烧得到的固体物质是 ;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是 。
若四种溶液,分别含有: ①Al3+ ②Mg2+ ③Fe2+ ④Fe3+ 离子。请回答下列问题:
(1)遇KSCN溶液呈红色的是 。
(2)加铁粉溶液质量增重的是 。
(3)加入过量NaOH溶液中最终无沉淀的是 。
(4)加入新制Cl2水溶液变黄色的是 ,反应的离子方程式是 。
下列化学方程式中,不能用离子方程式Ba2+ + SO42— = BaSO4↓表示的是
| A.Ba(NO3)2 +H2SO4= BaSO4↓+2HNO3 | B.BaCl2+ Na2SO4= BaSO4↓+2 NaCl |
| C.BaCO3 + H2SO4= BaSO4↓+ H2O+CO2↑ | D.BaCl2+ H2SO4= BaSO4↓+2HCl |
下列离子方程式中,正确的是
| A.NaAlO2溶液中通入少量二氧化碳:AlO2-+CO2+2H2O =Al(OH) 3↓+HCO3- |
| B.高锰酸钾酸性溶液与草酸溶液反应: 2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+ 8H2O |
| C.用稀硫酸除去铁片表面的铁锈:FeO+2H+ =Fe2++H2O |
D.用惰性电极电解饱和食盐水:2C1-+2H2O  Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
下列离子方程式书写正确的是
| A.用醋酸除去暖瓶中的水垢:2H++CaCO3="=" Ca2++ CO2↑+ H2O |
| B.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-==CaCO3↓+H2O |
| C.硫酸氢钠溶液与氢氧化钡溶液混合呈中性:H++SO42-+Ba2++OH-==BaSO4↓+H2O |
| D.FeO与稀硝酸反应:FeO+2H+==Fe2+ + H2O |
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
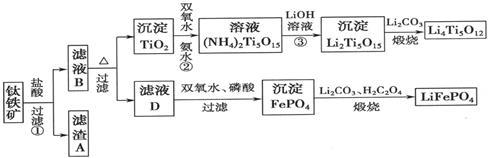
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl—= Fe2++ TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是___________。
(2)滤渣A的成分是___________。
(3)滤液B中TiOCl42-和水反应转化生成TiO2的离子方程式是 。
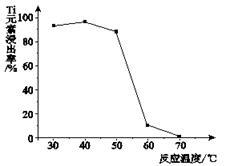
(4)反应②中固体TiO2转化成(NH4)2Ti5O15 溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因 。
(5)反应③的化学方程式是 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是___________。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12 + 3LiFePO4 Li7Ti5O12 + 3FePO4 该电池充电时阳极反应式是: 。
Li7Ti5O12 + 3FePO4 该电池充电时阳极反应式是: 。