北京市房山区高一上学期期末考试化学试卷
2015年8月12日晚上,天津滨海新区发生危险化学品爆炸事件。据报道,在仓库中存放有金属钠,下列关于钠的说法中不正确的是
| A.钠保存在煤油中 |
| B.钠着火可以用水浇灭 |
| C.钠在自然界中以化合态存在 |
| D.钠的焰色反应呈黄色 |
合金在生产及科研中具有广泛的应用。下列物质属于合金的是
| A.生铁 | B.石墨 | C.硅晶体 | D.水银 |
空气污染已成为人类社会面临的重大威胁。下列气体不属于大气污染物的是
| A.NO | B.CO2 | C.SO2 | D.NO2 |
下列物质中,既能与盐酸又能与氢氧化钠溶液反应,且有气体生成的是
| A.Si | B.SiO2 | C.Al | D.Al2O3 |
当光线通过下列分散系时,能观察到丁达尔效应的是
| A.稀盐酸 | B.CuSO4溶液 | C.酒精溶液 | D.Fe(OH)3 胶体 |
浓硫酸是实验室必备的重要试剂,下列有关它的说法不正确的是
| A.具有强腐蚀性 | B.能用于干燥氨气 |
| C.能使蔗糖变黑 | D.加热时能与铜发生反应 |
下列物质所属类别不正确的
| A.纯碱——碱 | B.氯化铝——盐 |
| C.金属钠——还原剂 | D.二氧化硅——酸性氧化物 |
下列关于CO的叙述正确的是
| A.CO的摩尔质量是28g |
| B.1molCO的质量是28g/mol |
| C.1molCO中所含分子数为6.02×1023个 |
| D.常温常压下,1molCO的体积为22.4L |
下列电离方程式不正确的是
| A.NaHCO3 = Na+ + H+ + CO32― | B.NaHSO4 = Na+ + H+ + SO42― |
| C.MgCl2 = Mg2+ + 2Cl― | D.Ba(OH)2 = Ba2+ + 2OH- |
下列离子方程式书写正确的是
| A.Cl2通入水中:Cl2+H2O===2H++Cl-+ClO- |
| B.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu===Fe2++Cu2+ |
| C.钠加入水中:Na+H2O===Na++OH-+H2↑ |
| D.铜片放入浓HNO3溶液中:Cu+4H++2NO===Cu2++2NO2↑+2H2O |
下列各组离子,能在溶液中大量共存的是
| A.OH-、H+、SO42-、Na+ | B.Na+、NO3-、SO42-、K+ |
| C.Cl-、Ag+、H+、NO3- | D.H+、CO32-、K+、Cl- |
下列变化中,需加入适当的氧化剂才能完成的是
| A.Fe→FeCl3 | B.CuO→Cu | C.HNO3→NO | D.SO3→H2SO4 |
下列各组混合物中,能用分液漏斗进行分离的是
| A.酒精和水 | B.碘和四氯化碳 | C.水和四氯化碳 | D.汽油和植物油 |
完成下列实验所选择的装置或仪器不正确的
| |
A |
B |
C |
D |
| 实验 |
分离 水和酒精 |
用铵盐和碱 制取NH3 |
用排空气法 收集NO2 |
用自来水 制取蒸馏水 |
| 装置 或 仪器 |
 |
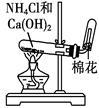 |
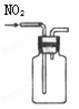 |
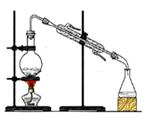 |
下列物质及用途对应不正确的是
| |
A |
B |
C |
D |
| 物质名称 |
氯气 |
小苏打 |
二氧化硅 |
氧化铁 |
| 用途 |
制漂白粉 |
治疗胃酸过多 |
制半导体材料 |
用作红色涂料 |
下列有关金属及其化合物的说法正确的是
| A.Na暴露于空气中最终生成Na2O2 |
| B.铜粉能溶于酸性硝酸钠溶解 |
| C.Fe比Al更易与NaOH溶液反应生成H2 |
| D.水蒸气通过灼热的铁粉会有红棕色固体生成 |
在KClO3+6HCl KCl+3Cl2↑+3H2O的反应中,被氧化的氯原子与被还原的氯原子的原子个数比是
KCl+3Cl2↑+3H2O的反应中,被氧化的氯原子与被还原的氯原子的原子个数比是
| A.1:6 | B.1:5 | C.6:1 | D.5:1 |
下列物质在给定条件下可以直接转化的是
A.Al2O3 AlCl3 AlCl3 Al(OH)3 Al(OH)3 |
B.Fe Fe2O3 Fe2O3 Fe2(SO4)3 Fe2(SO4)3 |
C.SiO2 H2SiO3 H2SiO3 Na2SiO3 Na2SiO3 |
D.CaCl2 CaCO3 CaCO3 CaO CaO |
用右图所示装置进行下列实验,实验结果与预测的现象不一致的是

| |
①中的物质 |
②中的物质 |
预测①的现象 |
| A |
酚酞溶液 |
浓盐酸 |
无明显现象 |
| B |
淀粉KI溶液 |
浓硝酸 |
无明显现象 |
| C |
AlCl3溶液 |
浓氨水 |
有白色沉淀 |
| D |
湿润红纸条 |
饱和氯水 |
红纸条褪色 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是
| A.0.1molCl2含有氯原子数为0.1NA |
| B.标准状况下,22.4LH2O含有的分子数为NA |
| C.3.4gNH3含有的分子数为0.2NA |
| D.0.5 mol/L Na2SO3溶液中Na+的物质的量浓度为0.25mol/L |
下列操作不能达到目的的是
| 选项 |
目的 |
操作 |
| A |
配制100mL1.0 mol·L-1 CuSO4溶液 |
将25 g CuSO4·5H2O溶于100 mL蒸馏水中 |
| B |
除去固体Na2CO3中的少量NaHCO3 |
将混合物加热充分反应 |
| C |
在溶液中将MnO完全转化为Mn2+ |
向酸性KMnO4溶液中通入SO2气体至紫色消失 |
| D |
确定NaCl溶液中是否混有Na2CO3 |
取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是
| A.上下移动①中铜丝可控制生成SO2的量 |
| B.②中选用品红溶液验证SO2的生成 |
| C.③中选用NaOH溶液吸收多余的SO2 |
| D.该反应中浓硫酸体现了强氧化性和脱水性 |
工业上制取纯硅的主要反应:SiCl4 + 2H2  Si + 4HCl。该反应中,被还原的物质是 (填化学式),作为还原剂的物质是 (填化学式);若反应中生成了1molSi,则转移电子 mol,消耗H2 mol。
Si + 4HCl。该反应中,被还原的物质是 (填化学式),作为还原剂的物质是 (填化学式);若反应中生成了1molSi,则转移电子 mol,消耗H2 mol。
若四种溶液,分别含有: ①Al3+ ②Mg2+ ③Fe2+ ④Fe3+ 离子。请回答下列问题:
(1)遇KSCN溶液呈红色的是 。
(2)加铁粉溶液质量增重的是 。
(3)加入过量NaOH溶液中最终无沉淀的是 。
(4)加入新制Cl2水溶液变黄色的是 ,反应的离子方程式是 。
A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):

请回答下列问题:
(1)若常温下A为淡黄色固体单质,D为强酸,则:
①A的化学式是 。
②反应x、y、z、w中,一定是氧化还原反应的有 。
③有关B的说法中正确的是 。
A.燃烧化石燃料不会产生B
B.造纸过程中可用B漂白纸浆
C.紫色石蕊试液遇B的水溶液会变红
D.可在葡萄酒中添加大量B作杀菌剂
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的
蓝色石蕊试纸变红。则:
①A的名称是。
②反应x的化学方程式是。
③反应w的离子方程式是。
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。

(1)小组同学在实验时,当打开A的分液漏斗的下面活塞后,发现漏斗内的液体未流下,其原因可能是 。
(2)配平装置E中反应的化学化学方程式:
MnO2 + HCl(浓) MnCl2 + +
MnCl2 + +
(3)A、E均开始反应,当观察到B、D中的品红溶液均已褪色时,停止反应通气。取下B、D两个试管,分别加热,出现的现象是 。
(4)当小组同学将SO2和Cl2按体积比1:1,同时通入到品红溶液时,观察到品红溶液几乎没有出现褪色现象,分析其原因可能是(用化学用语表示) 。
某研究性学习小组欲由硫铁矿烧渣(主要成分为Fe、Fe2O3、SiO2、Al2O3 )制备绿矾(FeSO4·7H2O),流程图如下:
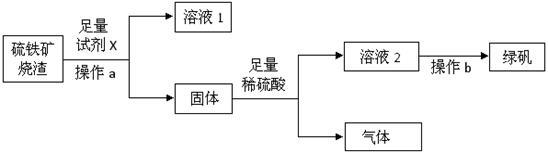
(1)操作a的名称是 。
(2)加入足量试剂X后,发生反应的离子方程式为 、 。
(3)若向溶液2中滴加KSCN溶液,无明显现象。固体与足量稀硫酸发生反应的离子方程式是 、 、 。
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。在实验室里按下图所示装置,可进行模拟实验证明Na2O2的供氧作用。

(1)A中发生反应的离子方程式是 。
(2)填写表中空格。
| 仪器 |
加入试剂 |
加入该试剂的目的 |
| B |
饱和NaHCO3溶液 |
|
| D |
|
|
(3)试管F中收集满气体后,验证该气体的实验操作方法是 。
(4)C中反应的化学方程式是 。

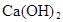
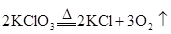
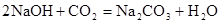
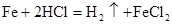
 粤公网安备 44130202000953号
粤公网安备 44130202000953号