(1)下列有关说法正确的是
A.可用石灰水区分Na2CO3与NaHCO3溶液;
B.HClO4的酸性强于H2SO3,所以非金属性:Cl﹥S;
C.配制0.2 mol·L-1的Na2CO3溶液480mL,需称量10.6g Na2CO3固体;
D.金属钠着火时,可用泡沫灭火器来灭火;
E.强酸可以制弱酸,弱酸通过化学反应一定不能生成强酸;
F.过量的Zn和浓硫酸反应,生成标准状况下气体22.4L,转移电子一定是2mol;
G.SO2使品红溶液褪色和使KMnO4溶液褪色都体现了其漂白性。
(2)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、NO3-、Cl-、SO42-中的4种离子,所含离子均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
①溶液中存在的离子是 ;
②写出溶液中加入过量的稀硫酸反应的离子方程式____________________;
③向原溶液中滴加足量NaOH溶液后,过滤洗涤灼烧,最终得到固体质量为 g。
(3)磷的一种化合物叫亚磷酸(H3PO3)。已知:
Ⅰ、0.1 mol/L H3PO3溶液的pH = 1.7;
Ⅱ、H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;
Ⅲ、H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。
关于H3PO3的说法:①强酸;②弱酸;③二元酸;④三元酸;⑤氧化性酸;⑥还原性酸,其中正确的是 。
A.②④⑥ B.②③⑥ C.①④⑤ D.②③⑤
写出H3PO3与过量NaOH溶液反应的离子方程式 。
下列离子方程式的书写与所得结论均合理的是
| 选项 |
离子方程式 |
结论 |
| A |
AgCl(s)+I﹣(aq)  AgI(s)+Cl﹣(aq) AgI(s)+Cl﹣(aq) |
溶解度:AgI>AgCl |
| B |
Fe2++H2O2+2H+===Fe3++2H2O |
氧化性:H2O2>Fe3+ |
| C |
CO32﹣+CO2+H2O===2HCO3﹣ |
稳定性:HCO3﹣>CO32﹣ |
| D |
NH3+H3O+===NH4++H2O |
得质子能力:NH3>H2O |
下列离子方程式正确的是
| A.以石墨作电极电解CuCl2溶液:2Cl-+2H2O=2OH-+Cl2↑十H2↑ |
| B.双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O |
| C.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| D.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O |
下列反应对应的离子方程式正确的是
| A.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合: HCO3- + Ca2++OH-=CaCO3↓+H2O |
| B.过氧化钠溶于水:2022-+2H2O=4OH-+O2↑ |
| C.用MnO2从酸化的海带灰中浸取液中提取碘:MnO2+2I-+2H2O=Mn2++I2+4OH- |
| D.向偏铝酸钠溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物。D物质常用于食品工业。写出④反应的化学方程式 ;
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式 ;
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式 ;
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式 ;
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式 。
下列离子方程式正确的是
| A.乙酸与碳酸钠溶液反应:2H++CO32-=CO2↑+H2O |
| B.向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| C.冷的氢氧化钠溶液中通入氯气: Cl2+ 2OH-=ClO- + Cl-+ H2O |
| D.明矾溶液中滴入Ba(OH)2溶液使SO42- 恰好完全沉淀: |
2Ba2++3OH-+Al3++2SO42-=2 BaSO4↓+Al(OH)3↓
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式 。
(2)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。

学科Ⅰ、步骤②需加入的试剂A是 (填化学式);
Ⅱ、步骤③通入的气体B是 (填化学式),写出该反应的离子方程式: 。
高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,离子方程式如下(未配平):
MnO4-+ Fe2++ H+ = Mn2++ Fe3++ H2O。下列说法正确的是
| A.MnO4-是氧化剂,Fe3+是还原产物 |
| B.Mn2+的还原性强于Fe2+ |
| C.离子方程式中按物质顺序的化学计量数是:1、5、8、1、5、4 |
| D.生成1 mol 水时,转移2.5 mol电子 |
现有十种物质:①铁单质 ②石墨 ③氯气 ④硫酸钡晶体 ⑤纯硫酸 ⑥盐酸 ⑦澄清石灰水 ⑧乙醇 ⑨熔化的硝酸钾 ⑩FeCl2溶液
(1)其中能导电的是 ,属于电解质的是 。
(2)请写出下列反应的离子方程式:
①与⑥反应: 。
③与⑦反应: 。
(3)H2O2能与酸性FeCl2溶液反应,请配平其化学方程式,标出电子转移的方向和数目。
HCl+ H2O2+ FeCl2= FeCl3+ H2O
其中被还原的元素是 ,氧化产物是 ,当生成9g的水时,反应转移 mol电子。
下列离子方程式的写法正确的是
| A.单质钠与水的反应:Na + H2O=Na+ + OH- + H2↑ |
| B.氢气在氯气中燃烧:H2+ Cl2=2H++ 2Cl- |
| C.小苏打治疗胃酸过多:H+ + HCO3-=H2O + CO2↑ |
| D.用氯化铁溶液腐蚀铜箔制造印刷电路板:Fe3++ Cu=Fe2++ Cu2+ |
下列与NaHSO3溶液有关的离子方程式书写错误的是
| A.NaHSO3溶液与FeCl3反应:HSO3-+2 Fe3++H2O=SO42-+2Fe2++3H+ |
| B.NaHSO3溶液和足量Ca(OH)2溶液反应:Ca2++OH-+HSO3-=CaSO3↓+H2O |
| C.NaHSO3溶液和稀HNO3反应:HSO3-+H+=SO2↑+H2O |
| D.NaHSO3溶液和NaAlO2溶液反应:HSO3-+ AlO2-+H2O=SO32-+Al(OH)3↓ |
下列离子方程式与所述事实相符且正确的是
| A.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2+ +2HCO3-+2OH-=CaCO3↓+CO32-+H2O |
B.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3- 3Fe3++NO↑+3H2O 3Fe3++NO↑+3H2O |
C.以铜为电极电解饱和食盐水:2 Cl-+2H2O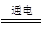 Cl2↑+ H2↑+ 2OH- Cl2↑+ H2↑+ 2OH- |
| D.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4 Fe2++2 Br-+3Cl2=4Fe3++6Cl-+Br2 |
下列离子方程式书写正确的是
| A.氯化铝溶液中加入过量氨水:Al3++ 4NH3·H2O=[Al(OH)4]- + 4NH4+ |
| B.澄清石灰水与过量苏打溶液反应:Ca2+ + HCO3-+ OH-=CaCO3↓+ H2O |
| C.碳酸钙溶于醋酸:CaCO3 + 2H+=Ca2+ +CO2↑+ H2O |
| D.碘化亚铁中通入氯气:2I-+ Cl2=I2+ 2Cl- |
下列离子方程式不正确的是
| A.NaHSO4溶液中加入过量Ba(OH)2溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| B.次氯酸钙溶液中加入亚硫酸钠:SO32-+Ca2+=CaSO3↓ |
C.NH4HCO3溶液中加足量NaOH溶液共热:HCO3-+NH4++2OH-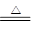 CO32-+NH3↑+2H2O CO32-+NH3↑+2H2O |
| D.硫酸亚铁溶液中加入用硫酸酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O |