在A、B两只烧杯中,依次分别盛有NaOH溶液、煮沸的蒸馏水,各滴入几滴饱和FeCl3溶液,试根据实验现象分别回答以下问题:
(1)分别写出两只烧杯中形成分散系的名称:A________,B________。
(2)写出A中形成分散系的离子方程式:________。
(3)写出B中形成分散系的化学方程式:________。
下列反应的离子方程式书写正确的是
| A.钠和冷水反应: Na+2H2O=Na++2OH-+H2↑ |
| B.金属铝溶于氢氧化钠溶液: Al+2OH-=AlO2-+H2 |
| C.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2 |
| D.铜和硝酸银溶液反应: Cu + 2Ag+ =" 2Ag" + Cu2+ |
下列离子方程式正确的是
| A.铁粉撒入稀硫酸中2Fe + 6H+ →2Fe3+ + 3H2↑ |
| B.向AlCl3溶液中加入过量的氨水:Al3++4NH3·H2O→AlO2-+4NH4++2H2O |
| C.把金属钠放入冷水中:Na+H2O→Na++OH-+H2↑ |
| D.用氢氧化钠溶液除去铝表面的氧化铝:Al2O3+2OH-→2AlO2-+H2O |
下列反应的离子方程式正确的是
| A.一定量的碳酸氢钠溶液中加入足量澄清石灰水 HCO3-+Ca2++OH-= CaCO3↓+H2O |
| B.漂白粉的稀溶液中通入过量SO2气体 Ca2++2ClO-+SO2+H2O = CaSO3↓+2HClO |
| C.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:2ClO-+CO2+H2O=2HClO+CO32- |
| D.Ba(OH)2溶液加入过量NaHSO4溶液中:H++SO42—+Ba2++OH—=BaSO4↓+H2O |
下列方程式书写正确的是
A.CO32-的水解方程式:CO32-+2H2O H2CO3+2OH- H2CO3+2OH- |
B.H2SO3的电离方程式H2SO3 2H++SO32- 2H++SO32- |
C.HCO3- 在水溶液中的电离方程式:HCO3-+H2O H3O++CO32- H3O++CO32- |
D.CaCO3的电离方程式:CaCO3 Ca2++CO32- Ca2++CO32- |
根据如图所示的化学反应框图解题。
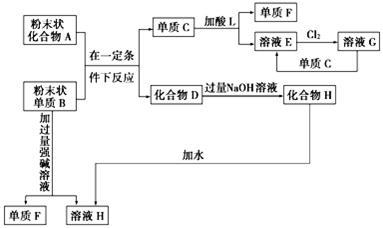
(1)单质F是 ,溶液H中所含的主要离子是 。
(2)写出下列反应的化学方程式:
C+L→F+E: ,
B→F+H: 。
(3)写出下列反应的离子方程式:
E+Cl2→G: ,
D→H: 。
下图中A~H均为中学化学中常见的物质,它们之间有如下转化关系。其中A、C均为金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应。(反应过程中生成的水及其他产物已略去)

请回答以下问题:
(1)A是(填名称) ; H是(填化学式) 。
(2)请写出反应C→D的化学方程式,并用单线桥或双线桥法标明该反应中电子转移的方向和数 目: 。
(3)Na2O2也可以生成D,写出其反应的化学方式: 。
(4)写出E转化为G的离子方程式: 。
(5)写出D转化为F的化学方程式: 。
下列离子方程式中,正确的是:
| A.稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ |
| B.氧化镁与稀盐酸混合:MgO + 2H+=Mg2++ H2O |
| C.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++ Ag |
| D.铁与稀硫酸反应2Fe + 6H+=2Fe3++3H2↑ |
下列电离方程式正确的是( )
A.H2SO4  2H+ + SO42 - 2H+ + SO42 - |
B.BaCl2= Ba2+ + 2Cl- |
| C.NH3 •H2O = NH4+ + OH- | D.Na2CO3= Na+ + CO32- |
将2.32 g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1 mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中错误的是( )

| A.OA段发生反应的离子方程式为:H++OH-===H2O CO+H+===HCO |
| B.当加入35 mL盐酸时,产生CO2的体积为224 mL(标准状况) |
| C.A点溶液中的溶质为NaCl、NaHCO3 |
| D.混合物中NaOH的质量0.60 g |
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,实验小组利用A制备Al(OH)3的操作流程如下:
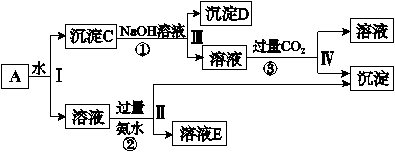
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中分离溶液和沉淀所采取的操作名称是______,该实验操作所用到的玻璃仪器有____ _。
(2)根据上述流程,写出D、E所含物质的化学式:沉淀D________;溶液E________、_______。
(3)写出②、③反应的离子方程式:
②__________ ___;③________ _____。
按照要求,回答下列问题
(1)写出下列物质熔融态的电离方程式:NaHSO4 。
(2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。滴加Na2CO3溶液时发生反应的化学方程式为 。
(3)写出制备Fe(OH)3胶体的化学方程式:__________ __。取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中逐渐滴加稀盐酸至过量,发生此变化的离子方程式为_______________。
按要求写出相关化学反应的表示式。
(1)实验室用强碱溶液吸收氯气的离子方程式:
(2)实验室用固固加热型装置制取氨气的化学方程式:
(3)工业上冶炼钢铁(原材料:氧化铁)的化学方程式:
(4)SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式:
 MnO4- +
MnO4- +  SO2 +
SO2 +  =
=  Mn2+ +
Mn2+ +  SO42- +
SO42- +  H+
H+
下列离子方程式正确的是( )
| A.Fe3O4与稀硝酸反应:Fe3O4+8H+2Fe3+十Fe2++4H2O |
| B.向硫酸铵溶液中加入氢氧化钡溶液:Ba2++So42-BaSO4↓ |
| C.氯化铝溶液中加入过量氨水:Al3++3OH—==Al(OH)3↓ |
| D.含0.4molFeBr2溶液与0.4molCl2恰好反应:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
氯酸钠(NaClO3)是无机盐工业的重要产品之一。
(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的 (填试剂化学式),过滤后即可得到。
(2)实验室制取氯酸钠可通过如下反应:3C12+6NaOH 5NaC1+NaC1O3+3H2O,先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子是 。
5NaC1+NaC1O3+3H2O,先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子是 。

(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠。则反应化学方程式为: 。
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L(NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,消耗体积15.62mL。
步骤4: 。
步骤5:数据处理与计算。
①步骤2中反应的离子方程式为 ;静置10min的目的是 。
②步骤3中K2Cr2O7标准溶液应盛放在 (填仪器名称)中。
③为精确测定样品中C1O3-的质量分数,步骤4操作为 。
(5)在上述操作无误的情况下,所测定的结果偏高,其可能的原因的原因是