已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
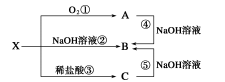
(1)写出下列物质的化学式:X ,A ,B C ;
(2)写出以下反应的离子方程式:
②
④
常温下,将0.01 mol CH3COONa 和0.002 molHCl溶于水,形成1L混合溶液:
(1)该溶液中存在三个平衡体系,用电离方程式或离子方程式表示①和②:
① 。
② 。
③CH3COOH CHCOO-+H+。
CHCOO-+H+。
(2)溶液中共有 种不同的粒子(指分子和离子),在这些粒子中,浓度为0.01 mol/L的是 ,浓度为0.002 mol/L的是 。
(3)在上述溶液中,存在的两个守恒关系是:
①物料守恒,C(CH3COO-)+C(CH3COOH)= mol/L;
②电荷守恒,即: 。
在如图所示的一些常见单质,化合物等物质之间的转化关系中(有些反应过程中的水,部分产物和反应条件未全部列出),已知反应①是氯碱工业的最基础的反应,A、B、F、H、J的焰色反应均为黄色,热的F溶液可以去除物品表面的油污,I为地壳中含量最多的金属元素的单质,L是典型的两性氧化物,在常温常压下C、D、G均为气体,D呈黄绿色,G是形成温室效应的主要气体.
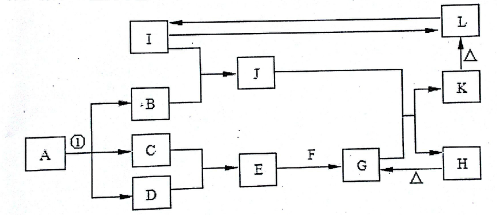
(1)反应①进行的条件为 .
(2)化合物F的化学式为 .
(3)I与氧化铁反应的化学方程式为 .
(4)J的水溶液与G反应生成K和H的离子方程式为 .
下列电离方程式书写正确的是
| A.Na3PO4═3Na++P5++4O2﹣ | B.H2SO4═H++SO42﹣ |
| C.NH3•H2O⇌NH4++O2﹣+H+ | D.NH4NO3═NH4++NO3﹣ |
已知A、B、C、D四种强电解质溶液,分别含有下列阴阳离子中的各一种,且互不重复:Ba2+、H+、Na+、NH4+、CO32﹣、NO3﹣、SO42﹣、OH﹣.已知:①A和B反应生成的气体能被D吸收,而A和D反应生成的气体能被B吸收;②向A或D中滴入C,均有白色沉淀产生.另有晶体E的摩尔质量为474g/mol,可用于自来水的净水剂.试判断:
(1)晶体E的名称为 ,用离子方程式和必要的文字说明E可用作净水剂的原理 .
(2)写出A、B、C的化学式:A ,B ,C .
(3)写出A与D反应的离子方程式 .
(4)将200mL0.5mol/L的B溶液加入到150mL0.2mol/L的E溶液中,最终生成的白色沉淀质量为 g.
下列框图所示的转化关系中,甲为生活中常见的金属单质,乙、丙、丁为气体单质,D为家庭中常用物质(部分反应物和生成物及溶剂水已略去).
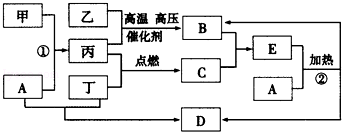
请回答:
(1)E的化学式为 ;甲的原子结构示意图为 ;
(2)反应①的离子方程式为 ;反应②的化学方程式为 ;
(3)实验室制取并收集B的操作中,用 法收集B,验证B已收集满的方法是 (限答一种).
(4)实验室制备丁的方程式为 ,工业上输送丁的管道出现气体泄漏,如何查漏(用方程式表示) .
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是 (用离子方程式表示),FeCl3净水的原理是 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+) = 1.0 × 10-3 mol·L-1 , c(Cl-) = 5.3 × 10-2 mol·L-1,则该溶液的pH约为 。
②完成NaClO3氧化FeCl2的离子方程式:  Fe2++
Fe2++ ClO3-+
ClO3-+  =
=  Fe3++
Fe3++ Cl-+
Cl-+ 。
。
(3)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是 (填序号)。
| A.加水稀释 | B.降温 | C.加入NH4HCO3 | D.加入NH4Cl |
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
下列离子方程式书写正确的是
| A.Cu与FeCl3溶液反应:Cu+ Fe3+= Cu2++ Fe2+ |
| B.碳酸钙溶于稀盐酸:CO32-+ 2H+ =H2O + CO2↑ |
| C.FeSO4溶液和NaOH溶液反应:Fe2+ + 2OH- = Fe(OH)2↓ |
| D.氯气溶于水:Cl2 + H2O = 2H+ + ClO- + Cl- |
有一包白色粉末状混合物,可能含有K2CO3、CuSO4、AlCl3、NaOH中的某几种,现进行如下实验:
① 将混合物溶于水,得到无色透明溶液。
② 取少量上述溶液两份:
第一份中加入稀硝酸,开始出现白色沉淀,有气泡产生,继续加入稀硝酸,沉淀全部溶解,再加入AgNO3溶液,又出现白色沉淀;
第二份进行焰色反应,直接观察,火焰呈黄色。
根据上述实验现象回答:
(1)原混合物中肯定有 。
(2)第一份中,继续加入稀硝酸,沉淀全部溶解的离子方程式为 。
(3)第一份中,再加入AgNO3溶液,又出现白色沉淀的离子方程式为 。
(4)第二份进行焰色反应,为什么观察不到K+的焰色反应 。
某工业废水中含有大量的FeSO4、较多的Cu2+和少量的Fe3+。为了较少污染并变废为宝,拟从该废水中回收硫酸亚铁和金属铜,其流程如下图。请完成下列问题。
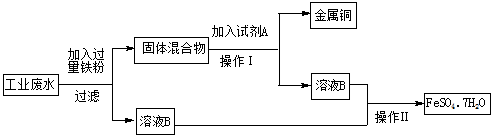
(1)检验工业废水中含有Fe3+的方法是 。
(2)工业废水中加入过量铁粉时,有Fe3+参加的离子反应方程式为 。
(3)操作Ⅰ为 。
下列离子方程式中书写正确的是
| A.金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B.用氢氧化钡溶液中和硫酸溶液:Ba2++OH-+H++SO42-=H2O+BaSO4↓ |
| C.氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O =AlO2-+ 4NH4++ 2H2O |
| D.在澄清石灰水中通入过量的CO2:OH-+CO2=HCO3- |
能正确表示下列反应的离子方程式是
| A.向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
B.实验室制氨气:NH4++OH-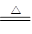 NH3↑+H2O NH3↑+H2O |
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-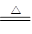 NH3↑+H2O NH3↑+H2O |
| D.AlCl3溶液中滴加足量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
向含有a molFeBr2的溶液中通入x molCl2。下列各项通入Cl2,溶液内发生反应的离子方程式,其中不正确的是
| A.当x=0.4a,2Fe2++Cl2=2Fe3++2Cl- |
| B.当x=0.6a,2Br-+Cl2=Br2+2Cl- |
| C.当x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- |
| D.当x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- |
下列离子方程式的书写正确的是( )
| A.实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O |
| B.向氯化亚铁溶液滴加新制氯水:2Fe2++Cl2=2Fe3++2Cl- |
| C.向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| D.铁和稀盐酸反应:2Fe+6H+=3H2↑+2Fe3+ |
盛放NaOH溶液的试剂瓶不能用玻璃塞,是为了防止发生反应(用离子方程式表示)________,避免瓶口与瓶塞粘在一起。