广东省潮州市高一上学期期末教学质检化学试卷
食盐、食醋、纯碱等都是厨房常用的物质,其中属于盐的是( )
| A.食盐和食醋 | B.食盐和纯碱 | C.纯碱和食醋 | D.全部 |
等物质的量的氢气和氨气在同温同压下具有相等的( )
| A.原子数 | B.体积 | C.质子数 | D.质量 |
现有三组溶液:①汽油和氯化钠溶液 ②49%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A.分液、蒸馏、萃取 | B.萃取、蒸发、分液 |
| C.分液、萃取、蒸馏 | D.蒸馏、萃取、分液 |
下列溶液中能够区别SO2和CO2气体的是( )
①澄清石灰水 ②H2S溶液 ③KMnO4溶液 ④品红溶液
| A.①②③ | B.①③④ | C.②③④ | D.①②③④ |
关于合金的叙述,不正确的是( )
| A.合金的熔沸点比原任一金属要高 |
| B.合金的硬度比原任一金属要大 |
| C.非金属也可以是合金的成分之一 |
| D.合金的用途比纯金属的用途更广 |
光纤通信是一种现代化的通信手段,制造光纤的主要原料是( )
| A.CaCO3 | B.CaO | C.Na2CO3 | D.SiO2 |
当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A.泥水 | B.盐酸 | C.Fe(OH)3胶体 | D.NaCl溶液 |
有关Na2CO3和NaHCO3的叙述中正确的是( )
| A.NaHCO3比Na2CO3热稳定性强 |
| B.Na2CO3和NaHCO3均可与澄清石灰水反应 |
| C.Na2CO3和NaHCO3均可与NaOH反应 |
| D.相同质量的Na2CO3和NaHCO3分别与足量稀盐酸作用时,产生的气体质量相同 |
在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。a和b分别是

| |
a(干燥气体) |
b(液体) |
| A |
NO2 |
水 |
| B |
CO2 |
水 |
| C |
Cl2 |
饱和食盐水 |
| D |
NH3 |
水 |
区别NaCl、FeCl3和NH4Cl三种溶液,可选用下列试剂中的( )
| A.KSCN溶液 | B.NaOH溶液 | C.AgNO3溶液 | D.BaCl2溶液 |
下列反应不能观察到“既有沉淀析出,又有气体产生”现象的是( )
| A.金属钠和硫酸铜溶液 | B.过氧化钠和氯化镁溶液 |
| C.氧化钠和氯化铵溶液 | D.硫酸铵和氢氧化钡混合加热 |
用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A.18g水中所含的电子数为8NA |
| B.常温常压下,28g氮气所含的原子数为2NA |
| C.0.5molCuO的摩尔质量为40g/mol |
| D.22.4L甲烷(CH4)所含的原子数为5NA |
下列溶液中,Na+浓度最大的是( )
| A.0.5mol/LNaCl溶液 | B.1L3mol/LNa2SO4溶液 |
| C.0.4mol/LNaOH溶液 | D.2L0.15mol/LNa3PO4溶液 |
在无色强酸性溶液中,下列各组离子能够大量共存的是( )
| A.K+、Ba2+、Cl-、SO42- | B.NH4+、HCO3-、Cl-、K+ |
| C.Cl-、Na+、NO3-、Ca2+ | D.Fe2+、NO3-、I-、Cl- |
下列离子方程式的书写正确的是( )
| A.实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O |
| B.向氯化亚铁溶液滴加新制氯水:2Fe2++Cl2=2Fe3++2Cl- |
| C.向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| D.铁和稀盐酸反应:2Fe+6H+=3H2↑+2Fe3+ |
下列实验现象与氧化还原反应有关的是
| A.氨水中滴加石蕊试液显蓝色 |
| B.NO2通入水中,气体由红棕色逐渐转变为无色 |
| C.萃取时向碘水中滴加适量的稀盐酸,有透明的凝胶形成 |
| D.向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 |
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )
A. 除去混有的杂质气体 |
B. 浓硫酸稀释 |
C. 分离出AgNO3溶液中的AgCl |
D. |
称量30.46g的NaOH固体
将铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液含有大量的阳离子是( )
| A.Cu2+和Fe2+ | B.H+和Cu2+ |
| C.Fe2+和Mg2+ | D.Fe3+和Fe2+ |
下列各组物质中,Y是X物质中含有的少量杂质,Z是除杂试剂,其中所加试剂最合理的一组是
| |
X |
Y |
Z |
| A |
NaHCO3溶液 |
Na2CO3 |
Ba(OH)2溶液 |
| B |
Fe2O3 |
Al2O3 |
NaOH溶液 |
| C |
FeCl3溶液 |
CuCl2 |
Fe |
| D |
Na2SO4溶液 |
Na2CO3 |
盐酸 |
在工农业生产和日常生活中经常用到的物质有下列几种:①Si ②NH4Cl ③Ca(ClO)2 ④Al(OH)3 ⑤Fe2O3。其中:电脑芯片中常用的物质是__________(填序号,下同);用于杀菌、消毒的物质 是____________;用作化肥的是____________;用作红色油漆和涂料的是___________;医用胃酸中和剂的是 _____________。
钠和铝是两种重要的金属。请回答下列问题:
(1)一小块金属钠放置在空气中,观察到的现象是_________(填序号,下同);若金属钠长时间在潮湿的空气中放置,最后生成的物质是_________。
A.金属表面逐渐失去光泽 B.氢氧化钠 C.碳酸钠
(2)将一小块金属钠投入水中,观察到的实验现象是________(填序号),发生反应的离子方程式为:__________________。
A.钠沉到水底 B.钠熔成小球 C.小球四处游动
(3)铝与稀硝酸反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,该反应的氧化剂是_______(填化学式),还原剂与氧化剂的物质的量之比是________,当有5.4gAl发生反应时,转移电子的物 质的量为________mol。
(1)如下图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到右瓶的现象是:__________,发生此现象的原因是__________。(用有关的方程式解释)
(2)为防止氯气尾气污染空气,根据氯气的性质,可用_________溶液吸收多余的氯气,原理是___________。(用化学方程式表示)根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,反应化学方程式为:_______________。长期露置于空气中的漂白粉,加稀盐酸后产生的气体是________(填序号)。
| A.O2 | B.Cl2 | C.CO2 | D.HClO |
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
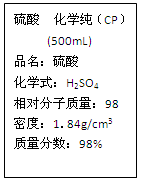
Ⅰ.硫酸具有A~D所示的性质,以下过程主要表现了浓硫酸的那些性质。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(1)浓硫酸可以干燥氢气____________________;
(2)浓硫酸使木条变黑____________________;
(3)热的浓硫酸与铜片反应______________。(填序号)
Ⅱ.现用该浓硫酸配制100 mL1.000mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒;⑧100mL容量瓶。请回答:
(1)配制稀硫酸时,上述仪器中需要使用的除①③⑤外,还有__________(填序号)。
(2)经计算,配制100mL1.000mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为__________mL。
(3)下列操作会使配制的溶液浓度偏高的是___________。
A.量取浓H2SO4时,俯视刻度线
B.定容时,俯视容量瓶刻度线
C.配置前,容量瓶中有水珠
D.定容后摇匀发现液面下降,但未向其中再加水
工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
(1)Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是:_____________。
(2)沉淀M中除含有泥沙外,一定还含有_________(填化学式),生成固体N反应的化学方程式为_________。
(3)滤液X中,含铝元素的溶质的化学式为___________,它属于__________(填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入___________(填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为__________________________。
(5)滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有__________________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号