能正确表示下列反应的离子方程式是
| A.向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
B.实验室制氨气:NH4++OH-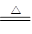 NH3↑+H2O NH3↑+H2O |
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-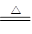 NH3↑+H2O NH3↑+H2O |
| D.AlCl3溶液中滴加足量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式 。
(2)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。

学科Ⅰ、步骤②需加入的试剂A是 (填化学式);
Ⅱ、步骤③通入的气体B是 (填化学式),写出该反应的离子方程式: 。
若四种溶液,分别含有: ①Al3+ ②Mg2+ ③Fe2+ ④Fe3+ 离子。请回答下列问题:
(1)遇KSCN溶液呈红色的是 。
(2)加铁粉溶液质量增重的是 。
(3)加入过量NaOH溶液中最终无沉淀的是 。
(4)加入新制Cl2水溶液变黄色的是 ,反应的离子方程式是 。
现有十种物质:①铁单质 ②石墨 ③氯气 ④硫酸钡晶体 ⑤纯硫酸 ⑥盐酸 ⑦澄清石灰水 ⑧乙醇 ⑨熔化的硝酸钾 ⑩FeCl2溶液
(1)其中能导电的是 ,属于电解质的是 。
(2)请写出下列反应的离子方程式:
①与⑥反应: 。
③与⑦反应: 。
(3)H2O2能与酸性FeCl2溶液反应,请配平其化学方程式,标出电子转移的方向和数目。
HCl+ H2O2+ FeCl2= FeCl3+ H2O
其中被还原的元素是 ,氧化产物是 ,当生成9g的水时,反应转移 mol电子。
下列框图所示的转化关系中,甲为生活中常见的金属单质,乙、丙、丁为气体单质,D为家庭中常用物质(部分反应物和生成物及溶剂水已略去).
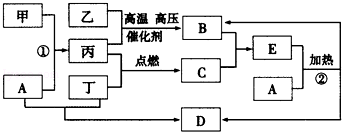
请回答:
(1)E的化学式为 ;甲的原子结构示意图为 ;
(2)反应①的离子方程式为 ;反应②的化学方程式为 ;
(3)实验室制取并收集B的操作中,用 法收集B,验证B已收集满的方法是 (限答一种).
(4)实验室制备丁的方程式为 ,工业上输送丁的管道出现气体泄漏,如何查漏(用方程式表示) .
下列与NaHSO3溶液有关的离子方程式书写错误的是
| A.NaHSO3溶液与FeCl3反应:HSO3-+2 Fe3++H2O=SO42-+2Fe2++3H+ |
| B.NaHSO3溶液和足量Ca(OH)2溶液反应:Ca2++OH-+HSO3-=CaSO3↓+H2O |
| C.NaHSO3溶液和稀HNO3反应:HSO3-+H+=SO2↑+H2O |
| D.NaHSO3溶液和NaAlO2溶液反应:HSO3-+ AlO2-+H2O=SO32-+Al(OH)3↓ |
下列离子方程式中,正确的是
| A.NaAlO2溶液中通入少量二氧化碳:AlO2-+CO2+2H2O =Al(OH) 3↓+HCO3- |
| B.高锰酸钾酸性溶液与草酸溶液反应: 2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+ 8H2O |
| C.用稀硫酸除去铁片表面的铁锈:FeO+2H+ =Fe2++H2O |
D.用惰性电极电解饱和食盐水:2C1-+2H2O  Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
下列离子方程式书写正确的是
| A.氯化铝溶液中加入过量氨水:Al3++ 4NH3·H2O=[Al(OH)4]- + 4NH4+ |
| B.澄清石灰水与过量苏打溶液反应:Ca2+ + HCO3-+ OH-=CaCO3↓+ H2O |
| C.碳酸钙溶于醋酸:CaCO3 + 2H+=Ca2+ +CO2↑+ H2O |
| D.碘化亚铁中通入氯气:2I-+ Cl2=I2+ 2Cl- |
下列离子方程式的书写正确的是( )
| A.实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O |
| B.向氯化亚铁溶液滴加新制氯水:2Fe2++Cl2=2Fe3++2Cl- |
| C.向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| D.铁和稀盐酸反应:2Fe+6H+=3H2↑+2Fe3+ |
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
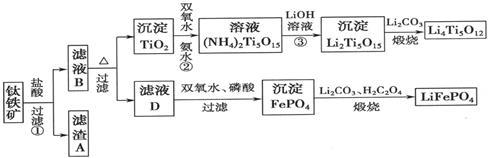
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl—= Fe2++ TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是___________。
(2)滤渣A的成分是___________。
(3)滤液B中TiOCl42-和水反应转化生成TiO2的离子方程式是 。
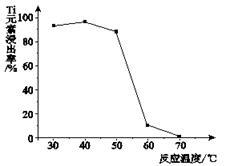
(4)反应②中固体TiO2转化成(NH4)2Ti5O15 溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因 。
(5)反应③的化学方程式是 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是___________。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12 + 3LiFePO4 Li7Ti5O12 + 3FePO4 该电池充电时阳极反应式是: 。
Li7Ti5O12 + 3FePO4 该电池充电时阳极反应式是: 。
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
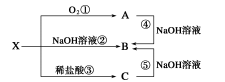
(1)写出下列物质的化学式:X ,A ,B C ;
(2)写出以下反应的离子方程式:
②
④
在如图所示的一些常见单质,化合物等物质之间的转化关系中(有些反应过程中的水,部分产物和反应条件未全部列出),已知反应①是氯碱工业的最基础的反应,A、B、F、H、J的焰色反应均为黄色,热的F溶液可以去除物品表面的油污,I为地壳中含量最多的金属元素的单质,L是典型的两性氧化物,在常温常压下C、D、G均为气体,D呈黄绿色,G是形成温室效应的主要气体.
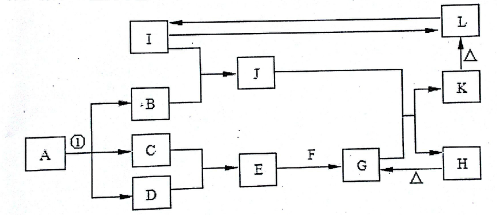
(1)反应①进行的条件为 .
(2)化合物F的化学式为 .
(3)I与氧化铁反应的化学方程式为 .
(4)J的水溶液与G反应生成K和H的离子方程式为 .
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是 (用离子方程式表示),FeCl3净水的原理是 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+) = 1.0 × 10-3 mol·L-1 , c(Cl-) = 5.3 × 10-2 mol·L-1,则该溶液的pH约为 。
②完成NaClO3氧化FeCl2的离子方程式:  Fe2++
Fe2++ ClO3-+
ClO3-+  =
=  Fe3++
Fe3++ Cl-+
Cl-+ 。
。
(3)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是 (填序号)。
| A.加水稀释 | B.降温 | C.加入NH4HCO3 | D.加入NH4Cl |
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
盛放NaOH溶液的试剂瓶不能用玻璃塞,是为了防止发生反应(用离子方程式表示)________,避免瓶口与瓶塞粘在一起。
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
其它性质 |
| SO2Cl2 |
-54.1 |
69.1 |
①易水解,产生大量白雾 ②易分解:SO2Cl2  SO2↑+Cl2↑ SO2↑+Cl2↑ |
| H2SO4 |
10.4 |
338 |
吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器A冷却水的进口为 (填“a”或“b”)。
(2)仪器B中盛放的药品是 。
(3)实验时,装置丁中发生反应的离子方程式为 。
(4)装置丙的作用为 ,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为 。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 + SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是 。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液): 。