湖南省长沙、浏阳、宁乡三市高三下学期模拟考试化学试卷
化学与生产、生活、社会密切相关。下列说法中不正确的是
| A.绿色化学的核心是从源头上消除工业生产对环境的污染 |
| B.“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 |
| C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈 |
| D.华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅 |
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是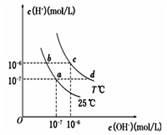
| A.d点对应的溶液中大量存在:Na+、K+、ClO-、Cl— |
| B.b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3- |
| C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+ |
| D.a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- |
用下列装置进行相应实验,能达到实验目的的是
| 选项 |
A |
B |
C |
D |
| 装置 |
 |
 |
 |
 |
| 目的 |
蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
分离CCl4萃取碘水后已分层的有机层和水层 |
制取少量CO2气体 |
除去Cl2中含有的少量HCl |
现有某氯化物与氯化镁的混合物,取3.8g粉末完全溶于水后,与足量的硝酸银溶液反应后得到12.4 g氯化银沉淀,则该混合物中的另一氯化物是
| A.FeCl3 | B.KCl | C.CaCl2 | D.LiCl |
已知AgCl的溶解度为1.5×10-4g , AgBr的溶解度为8.4×10-6g ,如果将AgCl和 AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生反应的结果为
| A.只有AgBr沉淀生成 | B.AgCl和AgBr沉淀等量生成 |
| C.AgCl沉淀多于AgBr沉淀 | D.AgCl沉淀少于AgBr沉淀 |
某有机化合物的结构简式为 ,有关该化合物的叙述不正确的是
,有关该化合物的叙述不正确的是
| A.该有机物的分子式为C11H12O2 |
| B.1 mol该物质最多能与4 mol H2发生加成反应 |
| C.该有机物能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀 |
| D.该有机物一定条件下,可以发生取代、氧化、酯化反应 |
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
| A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+ |
| B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 |
大气固氮 N2 (g)+O2 (g)  2NO(g) 2NO(g) |
工业固氮 N2 (g)+3H2 (g)  2NH3(g) 2NH3(g) |
|||
| 温度/℃ |
27 |
2000 |
25 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
0.507 |
0.152 |
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
|
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。


(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是 。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)
 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。已知:N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-12H2(g) +O2(g)
 2H2O(l) △H=-571.6kJ·mol-1
2H2O(l) △H=-571.6kJ·mol-1某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示: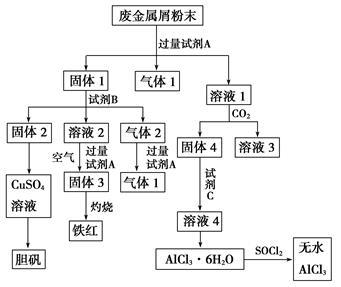
请回答:
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是_________________。
(2)溶液2中含有的金属阳离子是__________;气体2的成分是______________。
(3)溶液2转化为固体3的反应的离子方程式是____________________________。
(4)利用固体2制取CuSO4溶液有多种方法。
①在固体2中加入浓H2SO4并加热,使固体2全部溶解得CuSO4溶液,反应的化学方程式是___________。
②在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是_____________________________。
(5)溶液1转化为溶液4过程中,不在溶液1中直接加入试剂C,理由是__________________
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是______________。
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
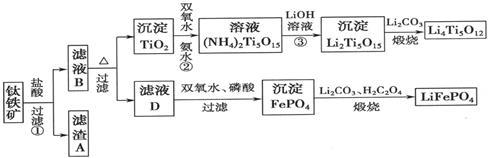
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl—= Fe2++ TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是___________。
(2)滤渣A的成分是___________。
(3)滤液B中TiOCl42-和水反应转化生成TiO2的离子方程式是 。
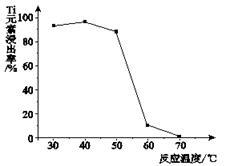
(4)反应②中固体TiO2转化成(NH4)2Ti5O15 溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因 。
(5)反应③的化学方程式是 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是___________。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12 + 3LiFePO4 Li7Ti5O12 + 3FePO4 该电池充电时阳极反应式是: 。
Li7Ti5O12 + 3FePO4 该电池充电时阳极反应式是: 。
火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用下图所示的工艺流程生产硫酸:
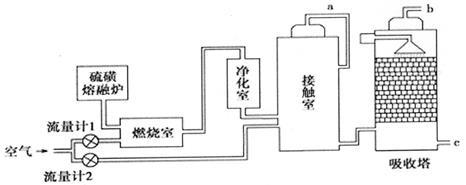
请回答下列问题:
(1)硫酸的用途非常广泛,可应用于下列哪些方面_ (可多选)
| A.橡胶的硫化 |
| B.表面活性剂“烷基苯磺酸钠”的合成 |
| C.铅蓄电池的生产 |
| D.过磷酸钙的制备 |
(2)为充分利用反应放出的热量,接触室中应安装 (填设备名称)。吸收塔中填充有许多瓷管,其作用是 .
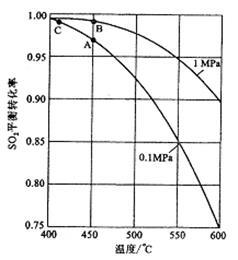
(3)如果进入接触室的混合气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强的关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压和450℃ ,而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是 ; 。
(4)为使硫黄充分燃烧,经流量计l通入燃烧室的氧气过量50%;为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍;则生产过程中流经流量计l和流量计2的空气体积比应为 。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 (空气中氧气的体积分数按0.2计),
(5)工业对硫酸厂尾气的处理方法一般是 。
A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| A |
原子核外L层电子数是K层的2倍 |
| B |
其一种单质被称为地球生物的“保护伞” |
| C |
元素的第一电离能是第3周期所有元素中最小的 |
| D |
基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
| E |
可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
请回答下列问题:
(1)C在元素周期表中位于第 周期、第 族;D的基态原子核外电子排布式是 。
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同) ,B、D的简单氢化物中稳定性较大的是 。
(3)B的常见单质和C的单质按物质的量比1∶2反应生成的化合物中化学键的类型为 ;该化合物属于 晶体。
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是 。
(5)已知:2AB(g)+B2(g)=2AB2(g) ΔH="-566.0" kJ·mol-1,D(s)+B2(g)=DB2(g) ΔH="-296.0" kJ·mol-1,处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式: 。
湖南盛产的山苍子油中柠檬醛含量很高,质量分数可达到60%-90%,柠檬醛也可以利用异戊二烯为原料人工合成,柠檬醛又可用来合成紫罗兰酮等香精香料,其合成路线如下:
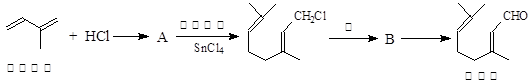

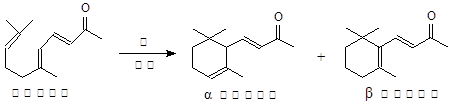
已知:
①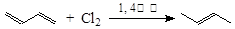
②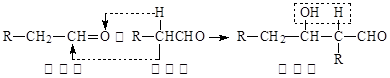
③同一碳原子连有两个双键结构不稳定。
试根据上述转化关系回答下列问题:
(1)写出A的结构简式 ,C的结构简式 。
(2)①对应的反应条件是 ,反应③的反应类型是 。
(3)写出B转化为柠檬醛的化学方程式 。
(4)根据反应②的反应机理写出CH3CHO与足量的HCHO反应产物的结构简式: 。
(5)检验柠檬醛中含有碳碳双键的实验方法是: 。
(6)α-紫罗兰酮、β-紫罗兰酮有很多同分异构体,则满足下列条件的同分异构体有 种。
①含有一个苯环;②属于醇类且不能发生催化氧化反应;③核磁共振氢谱显示有5个峰
 粤公网安备 44130202000953号
粤公网安备 44130202000953号