河北省秦皇岛市高一上学期期末考试化学试卷
日常生活中许多现象与氧化还原反应有关,下列现象与氧化还原反应无关的是
| A.古铜币上出现铜绿[Cu2(OH)2CO3] | B.铝制用品表面变暗 |
| C.钢铁生锈 | D.氢氧化钠固体潮解 |
为了除去镀在铁制品表面的铜镀层,可选用的试剂是
| A.稀硝酸 | B.浓硝酸 | C.浓硫酸 | D.浓盐酸 |
下列各组离子在加入Na2O2后能大量共存的是
| A.K+、H+、NO3-、SO32- | B.CO32-、Cl-、Fe2+、NH4+ - |
| C.Cu2+、Cl-、SO42-、K+ | D.Ba2+、K+、NO3-、Cl- |
下列试剂,既能与Na2CO3溶液反应,又能与NaHCO3的是
| A.CaCl2溶液 | B.BaCl2溶液 |
| C.NaOH溶液 | D.Ba(OH)2溶液 |
将0.2molCO2通入装有足量Na2O2的干燥管中,干燥管增重的质量为
| A.2.8g | B.5.6g | C.8.8g | D.11.2g |
2015年10月,屠呦呦因发现青蒿素和双氢青蒿素治疗疟疾的新疗法而获得诺贝尔生理学或医学奖。双氢青蒿素的化学式为C15H24O5,相对分子质量为284。下面关于双氢青蒿素的说法正确的是
| A.1mol双氢青蒿素的质量为284g∙mol-1 |
| B.双氢青蒿素的摩尔质量等于它的相对分子质量 |
| C.14.2g双氢青蒿素中含有的原子总数为2.2NA |
| D.含有6.02×1023个碳原子的双氢青蒿素的物质的量为1mol |
亚硝酸(HNO2)在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,其还原产物可能是
①NO ②NO2 ③HNO3 ④N2 ⑤NH3
| A.①③ | B.①②④ | C.①④⑤ | D.全部 |
下列装置或操作不能达到实验目的的是
| 目的 |
A.实验室制取并收集O2 |
B.检查装置气密性 |
C.制取蒸馏水 |
D.分离水和四氯化碳 |
| 装 置 或 操 作 |
 |
 |
 |
 |
下列转化中,均不能通过一步反应实现的是
| A.Na2O2→Na2CO3→NaOH | B.SiO2→Si→Na2SiO3 |
| C.NH3→NO2→HNO3 | D.S→SO2→NaHSO3 |
如图是产生和收集气体的实验装置,该装置最适合于( )
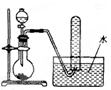
| A.用浓硝酸和Cu反应制取NO2 |
| B.用浓盐酸和MnO2反应制取Cl2 |
| C.用NH4Cl和Ca(OH)2反应制取NH3 |
| D.用H2O2溶液和MnO2反应制取O2 |
下列反应的离子方程式书写正确的是
| A.钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B.向Al2(SO4)3溶液中加入过量NH3∙H2O:Al3++4NH3∙H2O=AlO2-+4NH4++2H2O |
| C.酸性溶液中KClO3与KCl反应生成Cl2:ClO3-+Cl-+6H+=Cl2↑+3H2O |
| D.向含1molNaHSO3的溶液中加入1molNa2O2:Na2O2+HSO3-=2Na++SO42-+OH- |
将Na、Al2O3、HCl三种物质依次加入水中充分反应后,所得溶液中只含有NaCl一种溶质,则Na、Al2O3、HCl的物质的量之比可能为
| A.1:2:1 | B.3:2:1 | C.2:3:1 | D.1:2:3 |
为除去下列物质中所含的杂质,所选用的试剂或操作方法不正确的是
| 序号 |
物质 |
杂质 |
除杂所用的试剂或操作方法 |
| A |
KNO3溶液 |
KOH |
滴入稀HNO3的同时用pH试纸测定至溶液呈中性 |
| B |
FeSO4溶液 |
CuSO4 |
加入过量铁粉并过滤 |
| C |
H2 |
CO2 |
依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| D |
NaNO3 |
CaCO3 |
加稀盐酸溶解、过滤、蒸发、结晶 |
某实验小组设计实验测定Na2SO4和Na2CO3混合物中各组分的含量。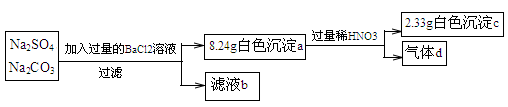
下列说法不正确的是
| A.沉淀a的主要成分是BaSO4和BaCO3 |
| B.滤液b中Na+的物质的量为0.08mol |
| C.气体d在标准状况下的体积为224mL |
| D.原混合物中Na2SO4与Na2CO3的物质的量之比为1:3 |
向浓度均为0.1mol∙L-1的HNO3、Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成沉淀的物质的量与加入NaOH溶液的体积的关系,其中合理的是
向含有a molFeBr2的溶液中通入x molCl2。下列各项通入Cl2,溶液内发生反应的离子方程式,其中不正确的是
| A.当x=0.4a,2Fe2++Cl2=2Fe3++2Cl- |
| B.当x=0.6a,2Br-+Cl2=Br2+2Cl- |
| C.当x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- |
| D.当x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- |
明胶是水溶性蛋白质混合物,溶于水会形成胶体。工业明胶制成的胶囊中往往含有超标的重金属Cr,因而对人体造成伤害。
(1)用一束光照射明胶水溶液,可观察到_________现象。
(2)Na2CrO4是工业中常用的氧化剂,工业上可用FeCr2O4(Cr元素的化合价为+3)制Na2CrO4,其反应为4FeCr2O4+8Na2CO3+7O2==8Na2CrO4+2Fe2O3+8CO2。
①FeCr2O4中铁元素的化合价为_______,用氧化物的形式表示FeCr2O4的化学式:________。
②该反应的氧化产物是________;每生成1mol Na2CrO4时,转移电子_____mol。
在某澄清溶液中,可能存在下列几种离子:H+、K+、Ba2+、SO42-、I-、CO32-。取该溶液进行下列实验:①用pH试纸检验,该溶液呈强酸性;②取200mL溶液加入少量氯水和少量CCl4,振荡后静置,CCl4层呈紫色;③另取部分溶液逐滴加入NaOH溶液,当溶液呈碱性时,再加入Na2CO3溶液,有白色沉淀生成。
(1)根据上述实验现象,推断原溶液中肯定存在的离子是_____________,肯定不存在的离子是_______,可能存在的离子是____________。
(2)若步骤②中消耗0.1molCl2,则溶液中与Cl2反应的离子的物质的量浓度为________________。
(3)写出实验③中生成白色沉淀的离子方程式:__________________________。
将一黑色固体单质甲投入乙的浓溶液中共热,剧烈反应产生混合气体A,A存在以下转化关系:
试回答下列问题:
(1)甲是_________,B是________。(填化学式)
(2)乙的溶液通常呈黄色,写出消除黄色且不降低乙溶液的浓度的方法:________________。
(3)写出生成混合气体A的化学方程式____________________________________。
(4)写出乙的稀溶液与单质丙反应的离子方程式:_______________________________________。
氯气在工农业生产在应用非常广泛。下图是实验室制备氯气并进行一系列相关实验的装置。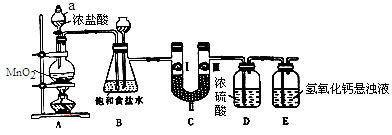
已知:MnO2+4HCl(浓)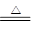 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)仪器a的名称为_______________。
(2)装置B中饱和食盐水的作用是______________________;装置B也作安全瓶,用来监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:_____________________。
(3)装置C的作用是验证氯气是否具有漂白性,为此装置C中I、II、III处依次放入______(填字母)。
| 选项 |
a |
b |
c |
| I |
湿润的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)装置E中氢氧化钙悬浊液的作用是______________;请写出相应反应的离子方程式:_______________。
将5.08g由Na2CO3和NaHCO3组成的固体混合物完全溶于水,制成溶液,然后向该溶液中逐滴加入2mol∙L-1的盐酸,所加入盐酸的体积与产生CO2体积(标准状况)的关系如图所示。
(1)写出OA段所发生反应的离子方程式:___________________。
(2)当加入35mL盐酸时,产生的CO2在标准状况下的体积为___________mL。
(3)原混合物中的Na2CO3和NaHCO3的物质的量之比为_________。
(4)NaHCO3固体受热分解的化学方程式为____________________。
霞石是一种含有铝和钠的硅酸盐,其组成为K2O∙3Na2O∙4Al2O3∙8SiO2,某小组同学设计以霞石为原料制备Al2O3的方案如下: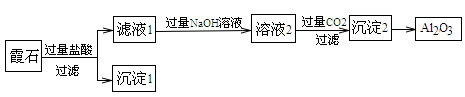
请回答下列问题:
(1)沉淀1的化学式为__________。
(2)滤液1与过量NaOH溶液反应的离子方程式为_____________________。
(3)写出由溶液2生成沉淀2的离子方程式:________________________。
(4)通入过量的二氧化碳,过滤后的滤液中含有的阴离子主要是__________________。
(5)由沉淀2→Al2O3的反应条件为______________。
(6)某同学提出上述流程较烦琐,可简化流程,其方法是向滤液1中加入足量的试剂X即可达到沉淀2,则试剂X为_____________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号