根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下列各题:
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2 080 |
4 000 |
6 100 |
9 400 |
| R |
500 |
4 600 |
6 900 |
9 500 |
| S |
740 |
1 500 |
7 700 |
10 500 |
| T |
580 |
1 800 |
2 700 |
11 600 |
| U |
420 |
3 100 |
4 400 |
5 900 |
(1)在周期表中,最可能处于同一族的是________。
A.Q和R
B.S和T
C.T和U
D.R和T
E.R和U
(2)下列离子的氧化性最弱的是________。
A.S2+ B.R2+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是______________________________。
A.硼 B.铍 C.氦 D.氢
(4)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明:________________________________________________________________________,
如果U元素是短周期元素,你估计它的第2次电离能飞跃数据将发生在失去第____个电子时。
(5)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是__________,其中________元素的第一电离能异常高的原因是_______________________________。
下表是元素周期表的一部分,回答下列有关问题: 1
1
(1)写出下列元素符号:①________,⑥________,⑦________。
(2)画出原子的结构示意图:④________,⑤________,⑧________。
(3)在这些元素中,最活泼的金属元素是________,最活泼的非金属元素是________,最不活泼的元素是________。(均用元素符号表示)
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是________,呈两性的氢氧化物是________。(均写出物质的化学式)
X、Y、Z、T为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,核电荷数Y<Z<X<T,则
(1)元素符号X Y Z T ;
(2)写出X的最高价氧化物对应水化物与Z的最高价氧化物对应水化物反应的离子方程式 ;
(3)按碱性减弱酸性增强的顺序,写出各元素最高价氧化物对应水化物的化学式为
A、B、C、D、E五种元素在周期表里的位置如下表所示:A、B、C为同主族元素,A为该族中原子半径最小的元素;D、B、E为同周期元素,E为该周期中原子半径最小的元素。
D元素名称是 ,在周期表第 周期,第 族,其原子结构示意图 。
A+、B―、C、D四种微粒中均有氢原子,且电子总数均为10个。溶液中的A+和B―在加热时相互反应可转化为C和D。则A+是 ,B―是 ,C是______,D是______。
(10分)X、Y、Z、R、W为五种原子序数依次增大的短周期元素。已知:
①X元素的原子半径是所有原子中最小的;
②Y元素的原子最外层电子数是最内层电子数的2倍。
③Y与R可以形成YR与YR2两种化合物,其中一种是造成温室效应的物质之一。
④W与R能形成原子个数之比为2:1和l:1的离子化合物甲和乙。
根据要求回答问题:
(1)R在周期表中的位置是 。
(2)Y、R、W三种元素的原子半径由大到小顺序为 (用元素符号表示)。
(3)X2R与乙反应的化学方程式是 。
(4)元素Y、R、W形成的化合物的水溶液常用作清洗厨房的油污,其原理是(用离子方程式表示) 。0.1 mol·L-1该溶液中,各种阴离子的浓度由大到小关系为 。
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3:1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)E元素在周期表中的位置 ;E元素价电子排布式为 。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是 (写分子式)。
(3)B与D形成的非极性分子的电子式为________。
(4)B、C、D三种元素的第一电离能由大到小的顺序是____________(用元素符号表示)。
(5)C的单质分子中σ键和π键的个数比为________。
(6)已知在25℃、101kPa下:ABC(aq)+A2D(1)BC-(aq)+A3D+(aq) ΔH=+45.6kJ·mol-1
A3D+(aq)+DA-(aq)=2A2D(1)ΔH=-57.3kJ·mol-1
则在25℃、101kPa的稀溶液中,ABC与DA-反应的热化学方程式是(以离子方程式表示): 。
(1 4分)X.Y、Z、W是元素周期表前四周期中常见的元素,原子序数依次增大,其相关信息如下表
| 元素 |
相关信息 |
| X |
由X形成的单质是最清洁的能源 |
| Y |
基态原子核外p能级电子总数比s能级少一个 |
| Z |
由Z形成的多种单质,其中之一是地球生物的“保护伞” |
| W |
含量位居地壳中金属元素的第二位 |
回答下列问题:
(1)Z位于元素周期表第 周期第 族,W的基态原子核外电子排布式为 。
(2)Y的第一电离能比Z (填“大”或者“小”);由X、Y、Z三种元素组成的一种盐的化学式为 。
(3)写出W元素的单质与X2Z在高温条件下反应的化学方程式 。
(4)在500℃、30MPa下,将1mol X2与足量的Y2置于密闭容器中充分反应生成YX3,当X2的转化率为25%时,放出热量为7.7kJ,则该反应的热化学方程式为: 。
针对下面10种元素,完成以下各小题
(1)地壳中含量最多的元素是___________(填名称)。
| 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
| 2 |
|
|
|
C |
N |
O |
|
|
| 3 |
Na |
Mg |
Al |
Si |
|
S |
Cl |
Ne |
(2)化学性质最不活泼的元素是___________(填元素符号)。
(3)Al的原子结构示意图为___________________。
(4)C与N相比,原子半径较小的是___________。
(5)最高价氧化物对应的水化物碱性最强的是___________(填化学式)。
(6)MgO和Al2O3中,属于两性氧化物的是___________。
(7)S和Cl相比,元素非金属性较强的是___________。
X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y的最高正价与最低负价的代数和为2,Z与X原子最外层电子数相同。回答下列问题:
(1)写出Z的离子结构示意图 。
(2)选用以上元素组成一种离子化合物,该化合物为______ 。(写一种即可)
(3)X和Y组成的化合物Q中,既含有极性共价键又含有非极性共价键,Q在空气中点燃时,迅速而安全的燃烧,其反应产物没有任何污染,燃烧时的化学方程式为 _ ;Q还可将酸性工业废水中的Cr2O72—还原为Cr3+,氧化产物为常见气体。相应的离子方程式为 。
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________________,该元素的符号是______;
(2)Z元素在周期表处在______区(填s、p、d),迄今该元素有______种同位素;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为______________________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是____________________________________________________;
(5)X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低顺序分别是(用化学式表示)_________________________________,__________________________________。
A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期且相邻,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。D、A按原子个数比3∶2形成离子化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是________________,乙物质的电子式是____________。
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是__________________(用元素符号填写)。
(3)E的单质遇到A的最高价氧化物对应的水化物的浓溶液会发生____________现象;但加入到C的最高价氧化物对应的水化物的溶液中能反应,反应的离子方程式是:_______ 。
(4)丙与水反应生成两种碱性物质,试写出该反应的化学方程式____________。
氢是宇宙中最丰富的元素,为一切元素之源。
23.H原子的电子排布式是“1s1”,该式子未表明电子运动状态的方面是 (选填编号)。
a.电子层 b.电子亚层
c.电子云的伸展方向 d.电子的自旋
24.金属锂与氢气在一定条件下能直接化合生成 LiH,以下事实能说明LiH是离子化合物的是 (选填编号)。
a.H为-1价 b.熔融状态能导电 c.加热到600℃不分解
LiH的电子式为 。
核外有2个电子的简单阴、阳离子有若干种,试比较它们半径的大小 。
25.非金属元素R的气态氢化物的化学式为H8-nR,则R的最高氧化物的化学式为 。
26.根据下表中的键能数据,写出氮气、氢气合成氨气的热化学方程式 。
在合成氨的工业生产中,科学家在努力寻找活性温度更低的新催化剂,简述其意义 。
| 共价键 |
键能(KJ/ mol) |
| N≡N |
946 |
| H-H |
436 |
| H-N |
391 |
27.钯(Pd)是优良的储氢金属:2Pd(s)+xH2(g)
 2PdHx (s) +Q(Q>0)
2PdHx (s) +Q(Q>0)
通常状况下,x的最大值为0.8,为使x>0.8可采取的措施是 ;为使PdHx产生H原子并在固体中快速流动,可采取的措施是 (选填编号)。
a.升温 b.减压 c.及时移走金属钯
4种短周期元素相对位置如下表。M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素。回答下列问题: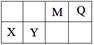
(1)X的原子结构示意图为 。
(2)0.1 molQ的10电子氢化物与CuO反应生成Cu2O、H2O和Q单质时,生成Cu2O的物质的量是 。
(3)Y的氧化物与NaOH溶液反应的化学方程式是 。
(4)HR是含M元素的一元酸。常温下,0.1 mol·L-1 HR 溶液中,c(H+) =1.3×10-3 mol·L-1。则HR H++R-的电离平衡常数Ka= (保留一位小数)。
H++R-的电离平衡常数Ka= (保留一位小数)。