工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质,并用来生产ZnSO4 ·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的 pH 如下表。

| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Cu(OH)2 |
| 开始沉淀的 pH |
3.3 |
1.5 |
6.5 |
5.4 |
4.2 |
| 沉淀完全的 pH |
5.2 |
3.7 |
9.7 |
8.0 |
6.7 |
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有____________。
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是______________。为使 Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为__________________。为控制上述pH范围可选择加入的试剂或药品是 。
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)常温下,已知 Ksp[Zn(OH)2]=5×10-17,某 ZnSO4溶液里c(Zn2+)=0.5mol/L,如果要生成Zn(OH)2沉淀,则应调整溶液 pH 大于_______________。
(4)当向含相同浓度Cu2+、Fe3+、Fe2+的溶液中滴加某浓度的NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]________Ksp[Cu(OH)2](填“>”、“=”或“<”)
将0.1 mol的镁、铝混合物溶于100 mL 2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如右图所示。

当V1=140 mL时,则金属粉末中:n(Mg) =________ mol,V2=______ ml。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=____________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a ,用100 mL 2 mol·L-1的H2SO4 ,再加入480 mL 1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是_________。
(1)KClO3与浓盐酸发生反应:KClO3+6HCl(浓)= KCl+3Cl2↑+3H2O,该反应中被氧化的元素和被还原的元素的质量之比为__________。转移1 mol电子时,产生标准状况下的Cl2__________ L。
(2)与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应: NaClO2+HCl→ClO2↑+NaCl+H2O
写出配平的化学方程式________________。生成0.2 mol ClO2转移电子的物质的量为________ mol。
(3)取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为__________________。如果向FeBr2溶液中通入等物质的量的Cl2,该反应的离子方程式为___________________________。
在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)  CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则

(1) 0~4 min CO的平均反应速率v(CO)=___________mol/(L.min)。
(2)达平衡时CO的转化率为____________,T1℃时该反应的平衡常数K=_______________。
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
| 时间(min) |
CO |
H2O |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
C1 |
C2 |
C3 |
C3 |
| 4 |
C1 |
C2 |
C3 |
C3 |
| 5 |
0.116 |
0.216 |
0.084 |
C4 |
①表中3~4 min时,反应v正__________v逆(填“>”、“<”或“=”); C1___________0.08mol/L(填“>”、“<”或“=”)。
②4~5 min时,平衡向逆反应方向移动,可能的原因是__________(填字母)。
a.增加水蒸气 b.降低温度 c.增大了CO2浓度 d.增加了氢气浓度
常温下,如果取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
①混合溶液的pH=8的原因(用离子方程式表示): 。
②求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)一c(A-)= mol/L,c(OH-)一c(HA)= mol/L。
③已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“大于”、“小于”或“等于”);
Ⅰ.选修3——物质结构与性质
已知A、B、C、D、E、F为元素周期表前四周期原子序数依次增大的六种元素。其中A的核外电子总数与其周期数相等,B原子核外有三个能级,每个能级上的电子数相同。D、E为同主族元素,且E的原子序数是D的2倍。F元素在地壳中含量位于金属元素的第二位。回答下列问题:
(1)元素F基态原子价层电子排布式为____________。
(2)B、C、D第一电离能由小到大的顺序为______________。(用元素符号表示)
(3)A与其它元素形成的二元共价化合物中,分子呈三角锥形,该分子的电子式为 ;分子中既含有极性共价键、又含有非极性共价键的18电子化合物有 (写出其中两种的化学式)。
(4)BE2分子中,按原子轨道的重叠方式的不同存在的共价键类型有 ;B原子的杂化轨道类型为 ;写出两种与BE2互为等电子体的分子或离子 。
(5)F单质的晶体在不同温度下有两种堆积方式,即面心立方堆积和体心立方堆积,其晶胞的棱边长分别为a cm、b cm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为______________,F原子配位数之比为______________。
从银铜合金废料中回收银并制备铜化工产品的工艺如下:
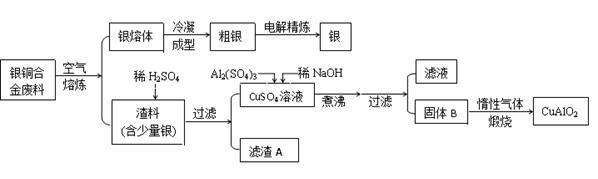
已知:①铝元素在溶液中的存在形态与溶液pH的关系如下图所示。

②室温时,Cu(OH)2的溶度积Ksp=2.0×10-20。(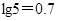 )
)
③Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃。
请回答下列问题:
(1)电解精炼银时,粗银做 极(填“阴”或“阳”),阴极电极反应为 。
(2)在生成固体B的过程中,需控制NaOH的加入量,使溶液的pH范围在 ,若控制不当,使NaOH过量可能会引起的反应的离子方程式为 。
(3)煅烧过程中发生多步反应,写出最终生成CuAlO2的反应的化学方程式: 。
(4)若银铜合金中铜的质量分数为64%,理论上1.0 kg废料中的铜可完全转化为CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液 L。
氨气在生产、生活和科研中应用十分广泛 。
(1)传统工业上利用氨气合成尿素
①以CO2与NH3为原料合成尿素的主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.47kJ/mol
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+72.49kJ/mol
反应2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH=_____________kJmol。
②液氨可以发生电离:2NH3(l) NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式______________。
NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式______________。
(2)氨气易液化,便于储运,可利用NH3作储氢材料已知:2NH3(g) N2(g)+3H2(g) ΔH=+92.4 kJ/mol 。
N2(g)+3H2(g) ΔH=+92.4 kJ/mol 。
①氨气自发分解的反应条件是________________(填“低温” 或 “高温”)。
②其他条件相同,该反应在不同催化剂作用下反应,相同时间后,氨气的转化率随反应温度 的变化如图所示。

在600℃时催化效果最好的是________________(填催化剂的化学式)。c点氨气的转化率高于b点, 原因是________________。
(3)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入到如图所示的电解池(电极为惰性材料)进行电解除去NH3,净化污水。该净化过程分两步:第一步电解产生氧化剂,第二步氧化剂氧化氨氮物质生成N2。
①写出电解时A极的电极反应式:________________。
②写出第二步反应的化学方程式:__________________。
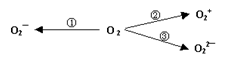
据2014年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子。
(1)下列有关O4的说法正确的是:
| A.O4分子内存在极性共价键 |
| B.合成O4的反应可看作核聚变反应,即不属于化学变化 |
| C.O4与O3、O2都是氧的同素异形体 |
| D.O4不可用作氧化剂 |
(2)制备含O2-、O22-甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:上述反应中, (填序号)相当于氧分子的氧化; (填序号)相当于氧分子的还原。
(3)写出O22—的电子式:
(4)O2[PtF6]是一种含有O2+的化合物,请写出一种含有O2-的氧化物的化学式:______________。
为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)若取ag样品,向其中加入足量的NaOH溶液,测得生成气体的体积(标准状况,下同)为b L 。反应的离子方程式为 。样品中铝的质量为 g。
(2)若使ag样品恰好完全反应,则反应中氧化铁与铝的质量比是 ,化学方程式为 。
(3)待(2)中生成物冷却后,加入足量盐酸,测得生成的气体体积为cL,该气体与(1)中所得气体的体积比c:b = 。
Ⅰ、碳元素是日常生活中接触非常多的一种元素,回答下列问题。
(1)用化学方程式表示溶洞生成的反应原理: 。
(2)可用稀盐酸来鉴别Na2CO3和NaHCO3溶液,现将稀盐酸慢慢滴入碳酸钠溶液中,请写出开始阶段发生反应的离子方程式 。
(3)写出用小苏打来治疗胃酸过多时发生反应的离子方程式: 。
II、氮元素在生命活动中扮演着重要的角色,回答下列与氮及其化合物有关的问题:
(1)德国化学家哈伯、波施等科学家成功地开发了将氮气转化为氨气的生产工艺。请用化学方程式表示工业合成氨的反应原理: 。
写出在氨气的出气口处,检验有氨气生成的操作:
(2)将氨气通入酚酞溶液中,酚酞溶液变成红色。请用方程式解释原因: 。
Ⅲ、印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”溶解铜。
(1)写出该反应的离子方程式: ;
(2)从使用过的腐蚀液中可以回收金属铜,下列试剂能实现的是 (填序号)
| A.氯气 | B.铁 | C.硝酸 | D.稀硫酸 |
(3)向使用过的腐蚀液中通入Cl2,可使Fe2+转化为Fe3+,写出反应的离子方程式 。
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气
候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减
排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡常数表达式为: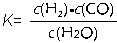 ,它所对应反应的化学方程式为 。
,它所对应反应的化学方程式为 。
(2)煤化工通常通过研究不同温度下的平衡常数以解决各种实际问题。已知等体
积的一氧化碳和水蒸气进入反应器时,会发生如下反应:
CO(g)+H2O(g)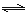 H2(g)+CO2(g)
H2(g)+CO2(g)
该反应的平衡常数随温度的变化如下表所示:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
①该反应的化学平衡常数表达式为K = 。
②该反应的正反应方向是 反应(填“吸热”或“放热”);
③若在500℃时进行,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化为 。
④800℃时,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,
c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率 (填“大”、“小”或“不能确定”)。
(3)2SO2(g)+O2(g)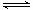 2SO3(g)反应过程中的能量变化如图所示:
2SO3(g)反应过程中的能量变化如图所示:
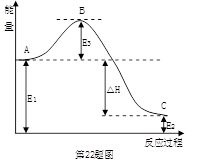
又已知1molSO2(g)氧化为1molSO3(g)的ΔH="-99" kJ·mol-1,
请回答下列问题:
 ①图中E1、E2分别表示 、 ,E3的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”或“降低”)△H (填“变大”、“变小”或“不变”),理由是____________________。
①图中E1、E2分别表示 、 ,E3的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”或“降低”)△H (填“变大”、“变小”或“不变”),理由是____________________。
 ②图中△H= kJ·mol-1。
②图中△H= kJ·mol-1。
氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下1gH2完全燃烧生成液态水,放出142.9kJ热量。则表示H2燃烧热的热化学方程式为___________ 。
又已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol,则氨在空气中燃烧生成液态水和氮气时的热化学方程式为 。
2NH3(g) ΔH=-92.4kJ/mol,则氨在空气中燃烧生成液态水和氮气时的热化学方程式为 。
(2)氢气是合成氨的重要原料。
①当合成氨反应达到平衡后,改变某一外界条件(不改变 N2、H2和NH3的量),反应速率与时间的关系如下图一所示。
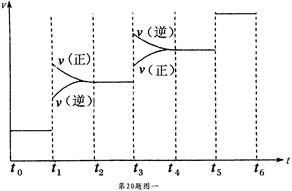
图中t1时引起平衡移动的条件可能是 ,其中表示平衡混合物中NH3的含量最高的一段时间
是 。
②温度为T℃时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%。则反应
的平衡常数为 。
③氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对于反应:N2O4(g) 2NO2(g) △H﹥0,在温度为T1、T2时,平衡体系中NO2的体积
2NO2(g) △H﹥0,在温度为T1、T2时,平衡体系中NO2的体积
分数随压强变化曲线如下图二所示。
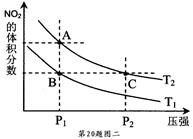
下列说法正确的是 。
a.A、C两点的反应速率:A﹤C
b.A、C两点的气体颜色:A浅,C深
c.B、C两点的气体平均相对分子质量:B﹤C
d.A、C两点的化学平衡常数:A﹥C
e.由状态B到状态A,可以用加热的方法
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO 2(g)+O2(g) 2SO3(g);△H=-190KJ·mol-1
2SO3(g);△H=-190KJ·mol-1
(1)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO38g,则V(O2)= mol·L-1·min-1,计算此时化学平衡常数K1= 。
(2)若温度不变,继续通入0.20mol SO2和0.10mol SO3,则平衡移动方向及原因是 ,达平衡后,化学平衡常数为K2,则K1、K2之间的关系为 (填 “>”、“<”或“=”)。
(3)有两只密闭容器A和B,A能保持恒容,B能保持恒压。起始时向容积相等的A、B中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应。则(填>、=、<;左、右;增大、减小、不变)。
①达到平衡所需要的时间:t(A) t(B)
②平衡时,SO2的转化率:a(A) a(B)
③达到平衡时,在两容器中分别通入等量的Ar气。B中的化学平衡向 反应方向移动,A中的化学反应速率 。
铜及其化合物在工农业生产及日常生活中应用非常广泛。某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2·2H2O)的流程如下:

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| 金属离子 |
Fe3+ |
Cu2+ |
| 氢氧化物开始沉淀时的pH |
1.9 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
6.7 |
请回答下列问题:
(1)溶液Ⅰ中加入试剂X可以调节溶液pH,从而除去Fe3+且不引人杂质
①试剂X选用下列物质中的_______(填代号)。
a.NaOH b.CuO c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是____________________________。
(2)检验溶液Ⅰ中的存在Fe3+实验操作是_____________________。
(3)向溶液Ⅱ中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因________________;
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不参与反应),实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2Cu↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为VmL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为___________;
②达到滴定终点时,仰视滴定管读数将使测定结果__________(填“偏高”“偏低”或“无影响”)
③该样品中的质量分数为__________(用含m,c,V的代数式表示,不用化简)。
(5)在空气中由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是________________。