为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙二人分别选用下列试剂进行实验:氨水、0.10 mol•L-1NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.010mol•L-1氨水的pH为10,据此他认定一水合氨是弱电解质,你认为这一方法是否正确?___________ (填“正确”或“不正确”),并说明理由_______________________;
(2)乙取出10mL 0.010mol•L-1氨水,用pH试纸测其pH为a,然后用蒸馏水稀释至1000mL,再用pH试纸测其pH为b,若要确认NH3·H2O是弱电解质他认为只要a、b满足什么关系?________________;
(3)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中abc三点对应的溶液中水的电离程度由大到小的顺序是 ___________;该醋酸溶液稀释过程中,下列各量一定变小的是____________。

a.c(H+) b.c(OH-) c. d.
d.
(4)在t℃时,某NaOH稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:①该温度下水的离子积常数Kw=___________(mol/L)-2;
②在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=_________。
食醋(主要成分CH3COOH)、纯碱(Na2CO3)和小苏打(NaHCO3)均为家庭厨房中常用的物质。已知:
| 弱酸 |
CH3COOH |
H2CO3 |
HNO2 |
| 电离常数 |
K=1.8×10-5 |
K=4.3×10-7 K=5.6×10-11 |
K=5.0×10-4 |
请回答下列问题:
(1)25℃时,0.10mol•L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-)____________;
(2)常温下,将20mL 0.10mol•L-1CH3COOH溶液和20mL 0.10mol•L-1HNO2溶液分别与20mL 0.10mol•L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v(CH3COOH )______ v(HNO2)(填“>”、“<”或“:”),原因是____________;
②充分反应后.两溶液中c(CH3COO-)______ c(NO2-)(填“>”、“<”或“=”)。
(3)25°C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中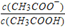 =_____;
=_____;
(4)常温下,下列方法可以使0.1mol·L-1CH3COOH的电离程度增大的是
a.加入少量的稀盐酸 b.加热溶液 c.加水稀释 d.加入少量冰醋酸
(5)PbSO4难溶于水却可溶于醋酸,你认为可能的原因是________。
①因醋酸是弱酸,故反应可进行 ②醋酸铅是弱电解质 ③醋酸铅在水中形成电离平衡时的c(Pb2+)小于PbSO4的溶解平衡的c(Pb2+)
(1)25℃时,浓度为0.1 mol•L-1的6种溶液①HCl ②CH3COOH ③Ba(OH)2④Na2CO3⑤KCl ⑥NH4Cl溶液pH由小到大的顺序为_________________(填写编号)。
(2)已知25℃时,CH3COOH电离常数Ka=1.7×10-5mol/L,则:
①该温度下CH3COONa的水解平衡常数Kh=__________ mol•L-1(保留到小数点后一位);
②将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3•H2O的电离常数Ka=____,混合后溶液中离子的浓度由大到小的顺序为__________________。
(3)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中
c(CH3COO-)+c(CH3COOH)=_________;m与n的大小关系是m___________n(填“>”“=”或“<”)。
(12分)乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,在100℃开始升华,157℃时开始分解。
(1)探究草酸的酸性
①已知:25℃ H2C2O4 K1=5.4×10-2,K2=5.4×10-5;H2CO3 K1=4.5×10-7 K2= 4.7×10-11
下列化学方程式正确的是
A.H2C2O4+CO32-= HCO3-+HC2O4- B.HC2O4-+CO32-= HCO3-+C2O42-
C.H2C2O4+CO32-= C2O42-+H2O+CO2 D.2C2O42-+CO2+H2O = 2HC2O4-+CO32-
②向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液。混合溶液中c(H+)>c(OH-),下列说法中正确的是 。
A.c(H2C2O4)>c(HC2O4-)
B.c(Na+)+c(H+)="2" c(C2O42-)+ c(HC2O4-)+c(OH-)
C.c(OH-)= c(H+)+2c(H2C2O4)+c(HC2O4-)
D.c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.02mol/L
(2)用酸性KMnO4溶液滴定Na2C2O4求算Na2C2O4的纯度。
实验步骤:准确称取1gNa2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中。再向瓶中加入足量稀H2SO4 ,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
①高锰酸钾溶液应装在 滴定管中。(填“酸式”或“碱式”)
②滴定至终点时的实验现象是: 。
③下列操作可能使测量结果偏高的是
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算Na2C2O4的纯度
汽车尾气中排放的NO和CO,可以通过加装催化转化器,使之转化为两种无污染的气体,
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-748 kJ/mol
N2(g)+2CO2(g) ΔH=-748 kJ/mol
在一定温度下,向2L的密闭容器中充入2.0molNO2.0molCO,在催化剂作用下发生反应,相关数据如下:
| |
0 min |
5min |
10min |
15min |
20min |
| c(NO) |
1.0 |
0.6 |
0.3 |
0.2 |
0.2 |
| c(N2) |
0 |
0.2 |
0.35 |
0.4 |
0.4 |
(1)5—10min,用CO的浓度变化表示的反应速率为: ;
(2)能说明上述反应达到平衡状态的是
A.2n正(NO) =n逆(N2) B.混合气体的平均相对分子质量不变
C.NO和CO的转化率相等 D.容器内气体压强不变
(3)20min时,向容器中加入1molNO和1molCO,再次达到平衡时,NO的转化率: (填“变大”、“ 变小”或“不变”)。
(4)计算此温度下的化学平衡常数K= ,或保持温度不变,此时再向容器内加入CO和CO2各1mol,平衡 移动(填“向左”、“ 向右”或“不”)。
(5)若反应开始向容器中加入1molN2和2molCO2,反应达到平衡时,吸收热量为 kJ。
工业生产硝酸铵的流程如下图所示:

(1)硝酸铵的水溶液呈 (填“酸性”、“中性”或“碱性”);其水溶液中各离子的浓度大小顺序为 。
(2)已知N2(g)+3H2(g) 2NH3(g) △H < 0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。
2NH3(g) △H < 0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。

①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 。
| A.及时分离出NH3可以提高H2的平衡转化率 |
| B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件 |
| C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N) |
| D.M点比N点的反应速率快 |
E.如果N点时c(NH3)=0.2 mol·L-1,N点的化学平衡常数K ≈ 0.93 L2/mol2
(3)尿素[ CO(NH2)2 ]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272 kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138 kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式: 。
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下左图所示:
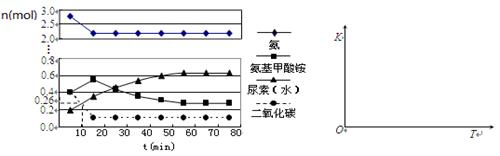
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
②在上右图中画出第二步反应的平衡常数K随温度的变化的示意图。
(5)电解尿素[ CO(NH2)2 ]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为______________________。
【选修3:物质结构与性质】
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为____________________________。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C________(填“>”或“<”,下同)B;第一电离能:N________O,原因是_________________________。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为_________________形,其中硫原子采用______________杂化,写出SO42-的一种等电子体的化学式:______________________。
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图所示(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围___________个O2-相紧邻。
(5)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71 g·cm-3,晶胞边长为4.28×10-10 m,则FexO中x=__________(用代数式表示,不要求算出具体结果)。
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。

实验操作I:在试管中加入5mL1mol/LNaOH溶液和5mL溴乙烷,振荡。
实验操作Ⅱ:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是________________________。
(2)观察到___ _现象时,表明溴乙烷与NaOH溶液已完全反应,写出发生的反应方程式:
(3)鉴定生成物中乙醇的结构,可用的波谱是____________________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是______,检验的方法是____________(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
根据以上信息回答下列问题:
(1)写出生产过程中所加试剂:X__________________,Y________________。
(2)生产中为了提高CuCl产品的质量,采用抽滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是________________;生产过程中调节溶液的pH不能过大的原因是________________。
(3)写出产生CuCl的化学方程式:______________________。
(4)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_____________。
近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 ;用这种方法处理SO2废气的优点是 。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:

①生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 。
②下列有关说法正确的是 (填序号)。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应III中发生反应的化学方程式为CaSO4+4C  CaS+4CO↑ CaS+4CO↑ |
| C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应V中的副产物氯化铵可用作氮肥 |
③反应V中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率
超过90%,选用40%的乙二醇溶液做溶剂的原因是 。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式 。
甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:

①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是____________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程, 除去甲醇的离子方程式为 。

孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2。以孔雀石为原料可制备CuSO4·5H2O步骤如下:

(1)写出孔雀石与稀硫酸反应的化学方程式:___________。
(2)溶液A的金属离子有Cu2+、Fe2+。实验步骤中试剂①最佳选____(填代号)。
A.KMnO4 B.Cl2 C.H2O2 D.HNO3
(3)溶液B中加入CuO作用是______________。
(4)常温下Fe(OH)3的Ksp=1×10-39,若要将溶液中的Fe3+转化为Fe(OH)3沉淀,使溶液中c(Fe3+)降低至1×10—3mol/L,必需将溶液pH调节至____。
(5)由溶液C获得CuSO4·5H2O晶体,需要经_______、______和过滤。
(6)可用KMnO4标准溶液测定溶液A中Fe2+的浓度,量取A溶液20.00ml,用0.010mol/L酸性KMnO4标准溶液滴定,消耗KMnO4 10.00ml, A溶液中Fe2+的物质的量浓度____mol/L.(反应原理:MnO4- + 5Fe2++8H+=Mn2++5Fe3++4H2O)
[化学—化学与技术]以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:

回答下列问题:
(1)焙烧硫铁矿的主要方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、 。
(3)通氯气氧化后时,发生的主要反应的离子方为 ;
该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式) 。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在:
(5)如果将氯化铁晶体(FeCl3·6H2O)放在坩埚中加热灼烧,最后得到的固体为 。
(6)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K= ;工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
2SO3(g),该反应的平衡常数表达式为K= ;工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
①V2O5作催化剂 ②通入过量O2 ③SO2、O2进行二次氧化 ④通入过量SO2
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量Fe2O3 、FeCO3 、MgO、CaO等,生产工艺流程图如下:

(1)将菱锌矿研磨成粉的目的是___________________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+ □____+ □_____="=" □Fe(OH)3 + □Cl_
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H ,化学式式量为89,化学式是_______ 。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______ 。
| |
Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
| 开始沉淀的pH |
10.4 |
6.4 |
— |
— |
| 沉淀完全的pH |
12.4 |
8.0 |
— |
— |
| 开始溶解的pH |
— |
10.5 |
— |
— |
| Ksp |
5.6×10-12 |
— |
6.8×10-6 |
2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是_________(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为 ______ 、_______ 、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于 。
欧盟定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6
kJ热量。该反应的热化学方程式: 。
(2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
 物质 物质T/℃ n/mol |
活性炭 |
NO |
E |
F |
| 初始 |
2.030 |
0.100 |
0 |
0 |
| T1 |
2.000 |
0.040 |
0.030 |
0.030 |
| T2 |
2.005 |
0.050 |
0.025 |
0.025 |
①写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数为 K1,T2℃时的平衡常数为 K2。
Ⅰ.K1 = 。(列式并计算)
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2 b.T1<T2 c.无法比较
(3)CO2经常用氢氧化钠溶液来吸收,现有0.4molCO2,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: 。
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有很高的发电效率,因而受到重视,该电池用 Li2CO3和 Na2CO3的熔融盐混合物作电解质,CO 为阳极燃气,空气与 CO2的混合气为阴极助燃气,制得在 650 ℃下工作的燃料电池,其阳极反应式:2CO-4e—+ 2CO32— =4CO2,则阴极反应式为: 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。