烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_______mol·L-1。
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见下图。

①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是 。
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是 。
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为8)中SO32-将NO2转化为NO2-,其离子方程式为: 。
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)= [用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是 。
将16.8g碳酸氢钠与11.7g过氧化钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,得到残余固体X。
(1)写出碳酸氢钠分解产生的气体分别与过氧化钠反应的化学反应方程式:
_________________、_________________________。
(2)残余固体X的成分是____________。
| A.Na2O2、NaOH | B.Na2O2、Na2CO3 | C.NaOH、Na2CO3 | D.Na2O2、NaOH、Na2CO3 |
(3)向固体X中逐滴加入1mol/L的稀盐酸至不再产生气泡为止,产生的气体在标准状况下的体积为____L。请以V(HCl)为横坐标,V(CO2)为纵坐标,画出产生CO2的体积和加入稀盐酸溶液体积的关系。
将0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则:
(1)混合溶液中c(A-)________c(HA)(填“>”“<”或“=”,下同)。
(2)混合溶液中c(HA)+c(A-)________0.1 mol·L-1。
(3)混合溶液中,由水电离出的c(OH-)________0.2 mol·L-1 HA溶液中由水电离出的c(H+)。
(4)25 ℃时,如果取0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度________NaA的水解程度。
(1)如图1是一种新燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。
①写出A极发生的电极反应式______________________;
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与____________极(填:“C”或“D”)相连;
③当消耗1.12L(标况下)CO时,粗铜电极理论上减少铜的质量不超过__________克。
(2)工业上,可用铁作阳极,电解KOH溶液制备K2FeO4。
①电解过程中,OH-向_________(填“阴”或“阳”)极移动,阳极的电极反应式为______________;
②若阳极有28gFe溶解,则阴极析出的气体在标准状况下的体积为___________L。
下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L硫酸溶液,其他试剂任选。填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是___________。
(2)实验开始时应先将活塞E______________(填“打开”或“关闭”)
(3)简述生成Fe(OH)2的操作过程________________________________
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:_________________________。
I. 书写下列反应的化学方程式
(1) 用FeCl3溶液作为腐蚀液刻制铜印刷电路板 ;
(2) 工业上粗硅的制取:
II. 与量有关的离子方程式书写
(1) Ba(OH)2溶液与NaHSO4溶液反应后溶液呈中性:
离子方程式 ;
(2) Ca(HCO3)2溶液与少量NaOH溶液反应
离子方程式 ;
(3) Al2(SO4)3溶液与过量NaOH溶液反应
离子方程式 ;
(学法题)书写此类离子方程式的关键是: 。
关于平衡常数表达及影响因素的易混易错题组
运用化学反应原理研究碳、氮等单质及其化合物的反应有重要意义。
(1)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2分析,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(2)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
①4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
②为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。
(3)25℃时,反应2CO2(g) 2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。
2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。

回答下列问题:
(1)已知两种同素异形体A、B的燃烧热的热化学方程式为:
A(s)+O2(g)= CO2(g) △H=-393.51kJ/mol
B(s)+O2(g)= CO2(g) △H=-395.41kJ/mol
则两种同素异形体中较稳定的是(填“A”或“B”) 。
(2)工业上用H2和Cl2反应制HCl,各键能数据为:H-H:436kJ/mol,Cl-Cl:243kJ/mol,H-Cl:431kJ/mol。该反应的热化学方程式是 。
(3)合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:
①2CH4(g)+O2(g) 2CO(g)+4H2(g);ΔH1="-72" kJ·mol-1
2CO(g)+4H2(g);ΔH1="-72" kJ·mol-1
②CH4(g)+H2O(g) CO(g)+3H2(g);ΔH2="+216" kJ·mol-1
CO(g)+3H2(g);ΔH2="+216" kJ·mol-1
氢气与氧气反应生成水蒸气的热化学方程式为 。
现有1 mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应。
若x=0.2时,反应①放出的能量为 kJ。
若x= 时,反应①与②放出(或吸收)的总能量为0。
开发利用清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题。甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g) CH3OH(g) ∆H ="-105" kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g) ∆H ="-105" kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
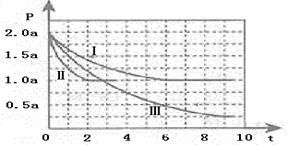
(1)①Ⅱ和Ⅰ相比,改变的反应条件是 。
②反应Ⅰ在6 min时达到平衡,在此条件下从反应开始到达到平衡时v (CH3OH) = 。
③反应Ⅱ在2 min时达到平衡,平衡常数K(Ⅱ)= 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1 mol CO和3 mol CH3OH后v(正)_______ v (逆)。(填“>”“<”“=”),原因是:_______________________。
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),判断的理由是________________________。
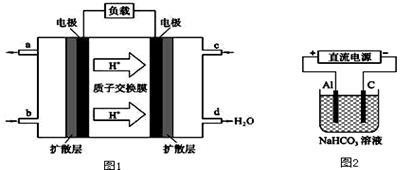
(2)某研究所组装的CH3OH﹣O2燃料电池的工作原理如图1所示。
①该电池负极的电极反应式为: 。
②以此电池作电源进行电解,装置如图2所示。发现溶液逐渐变浑浊并有气泡产生,其原因是 (用相关的离子方程式表示)。
(1)2015年8月12日天津港危化品爆炸,教训极为深刻。其中化学品之一是氰化钠(NaCN):白色固体,可溶于水,剧毒,致死量50~250mg。氰化钠遇水或酸生成剧毒易燃的氰化氢(HCN)气体。处理氰化物可用碱性氯化法,该方法发生三步反应,写出其离子方程式。
①氯气与氢氧化钠溶液反应生成次氯酸盐(ClO-): 。
②次氯酸盐氧化氰化物(CN-)生成氰酸盐(CNO-):ClO-+CN-=CNO-+2Cl-
③过量的次氯酸盐氧化氰酸盐生成CO32-和N2: 。
(2) 用ClO2处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2和CO2。若处理含NaCN 4×10-5mol·L-1的废水 1000L,至少需要ClO2的质量为___________g。
(3)化学是一门以实验为基础的科学,下列叙述正确的是______(填写序号).
①将0.2mol•L-1FeCl3溶液滴加到沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体.
②分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出。
③用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒和胶头滴管。
④托盘天平、容量瓶、量筒、滴定管等定量仪器均标有0刻度线。
⑤除去CO2中HCl,可将混合气体通过盛有饱和Na2CO3溶液的洗气瓶。
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾。
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有 。
。
(4)化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
| A.定性检验SO32-,可用HNO3酸化的BaCl2溶液 |
| B.配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度 |
| C.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液 |
| D.检验氧化铁中的氧化亚铁,先用硫酸溶液溶解,然后加入盐酸酸化的高锰酸钾溶液 |
物质A~E均含同种元素,都是中学化学中常见的物质,它们可发生如图所表示的反应。已知A是一种淡黄色的固体,B是银白色金属单质。

(1)反应⑤可用于潜水艇中制取氧气,相关的化学方程式为:_________,氧化剂是________,还原剂是__________;
(2)根据反应②相关的现象,从表格下方找出相应性质序号填在表格中,并在对应的位置写上该反应的化学方程式。
| |
现象 |
单质B的相关性质(填序号) |
相关的化学方程式 |
| I |
单质B浮在水面上 |
|
|
| II |
熔成一个小球 |
|
|
| III |
四处游动,发出嘶嘶的声音 |
|
|
| IV |
滴入酚酞试剂,溶液变红 |
|
与反应现象相应的性质:①反应后生成了酸性物质;②反应后生成了碱性物质;③单质B的熔点低;④单质B的密度比水的小;⑤生成了气体;⑥单质B的密度比水的密度大;
(3)D和E分别与等浓度的盐酸反应,相同条件下生成等体积的气体,则以下说法正确的是:
________(填序号)
①消耗D的质量较多;②消耗E的质量较多;③D消耗盐酸的体积更大 ④E消耗盐酸的体积更大
为了确认电解质溶液X的成分,某同学做了以下两组实验,请根据实验回答问题:
| 编号 |
I |
II |
| 实验一 |
  |
 |
| 编号 |
III |
|
| 实验二 |
 |
(1)实验步骤I中无明显现象,实验步骤II中发现溶液变红色,相关的离子方程式为:_______________________;
(2)实验步骤III中反应的离子方程式为:___________________________;
(3)实验一证明X溶液中含__________离子,实验II证明X溶液中含_________离子。(填离子符号)
(1)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有____性(填氧化性或还原性)。铁粉也可以将Fe3+转变为易吸收的Fe2+,离子方程式为:_________________。
(2)印刷电路板是高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”溶解铜箔,生成CuCl2和FeCl2相关的化学方程式:________________________。
化学反应原理是中学化学学习的重要内容。请回答下列问题:
(1)下列判断正确的是______________。
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH1 CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH2
则ΔH1﹤ΔH2
②H2(g)+ O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
则ΔH1﹤ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时反应放出的热量分别为Q1和Q2
则Q1﹤Q2
④CaCO3(s)===CaO(s)+CO2(g)ΔH1 CaO(s)+H2O(l)===Ca(OH)2(s)ΔH2
则ΔH1﹤ΔH2
(2)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)
设计的原电池如图所示。

请回答下列问题:
①铜电极发生的电极反应为_____________________。
②溶液中Cu2+向________极移动。
(3)在一恒温、恒容密闭容器中充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g) + 3H2(g)  CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如图所示。

回答下列问题:
①Y的化学式是 。
②反应进行到3min时, v正 v逆(填“>”或“<”、“=”)。反应前3min,H2的平均反应速率,v(H2)= mol·L-1·min-1。
③能证明该反应达到化学平衡状态的依据是 。
| A.容器内各气体的体积分数保持不变 |
| B.混合气体密度不变 |
| C.3v逆(CH3OH) =v正(H2) |
| D.混合气体的平均相对分子质量不变 |
E.CO2的转化率为70%
F.混合气体中CO2与H2的体积比为1﹕3
④上述温度下,反应CH3OH (g) + H2O(g)  CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
⑤上述反应达到平衡后,往容器中同时加入0.1mol CO2和0.3mol H2O (g),此时平衡将 (填“向左”、“向右”或“不”)移动。
(4)室温时,向20 mL 0.1 mol/L的醋酸溶液中不断滴入0.1 mol/L的NaOH溶液,溶液的pH变化与所加NaOH溶液体积的关系如下图所示。下列有关溶液中离子、分子浓度大小关系的描述中正确的是____________。
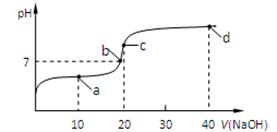
①.a点时:c(CH3COOH) >c(CH3COO-) > c(Na+) > c(H+) >c(OH-)
②.b点时:c(Na+)=c(CH3COO-) >c(H+) =c(OH-)
③.c点时:c(OH-)=c(CH3COOH)+c(H+)
④.d点时:c(Na+)> c(CH3COO-) > c(OH-) >c(H+)
镁是一种重要的金属资源,在工业上用途广泛。回答下列问题:
(1)已知某温度下Mg(OH)2的Ksp = 6.4×l0-12,当溶液中c(Mg2+) ≤1.0×10-5mol/L可视为沉淀完全,则此温度下应保持溶液中c(OH-) ≥ ______mol·L-1。
(2)已知常温下CH3COOH的电离常数为:Ka = l.75×10-5mol/L;NH3·H2O的电离常数为,Kb =1.76×l0-5mol/L。A.NH4Cl溶液显酸性,原因是_________________________(用离子方程式表示),NH4Cl溶液中所有离子的浓度由大到小的顺序为_________________________;
B.CH3COONH4溶液显___________ (填“酸”、“碱”或“中”)性。
C.将饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,可看到白色沉淀溶解。产生这种现象的原因存在以下两种观点。
观点①:2NH4+ + Mg(OH)2= 2NH3·H2O+ Mg2+ ;
观点②的离子方程式为_________________________。
要验证①和②谁是Mg(OH)2溶解的主要原因,可选取______________(填序号)代替NH4Cl溶液作对照实验。
a. NH4NO3 b. (NH4)2SO4 c. CH3COONH4 d. NH4HSO4