现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.
(1)a点对应的沉淀为______________(填化学式)。
(2)计算原混合液中FeCl3的物质的量浓度为多少?(写出计算过程)
已知:MnO2+4HCl MnCl2+Cl2↑+2H2O,一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成4.48L氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(所设反应前后体积不变),请计算:
MnCl2+Cl2↑+2H2O,一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成4.48L氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(所设反应前后体积不变),请计算:
(1)反应耗用MnO2的质量;(2)被氧化的HCl物质的量;(3)跟浓盐酸的物质的量浓度。
将一定质量的镁铝合金投入100 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示。请回答以下问题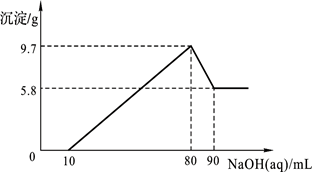
(1)当沉淀达到最大值时,求Al(OH)3的质量;
(2)原合金中Mg的质量;
(3)盐酸的物质的量浓度。
氯化亚铜(CuCl)广泛用于有机合成、气体吸收、冶金、医药化工等行业。
(1).工业上氯化亚铜可由下列反应制备:
2CuSO4+ Na2SO3 + 2NaCl + Na2CO3® 2CuCl ↓+ 3Na2SO4 + CO2↑。制备过程中需要20% 的CuSO4溶液,配制100g 该CuSO4溶液需要胆矾 g,需要水 g。
(2).实验室可用如下方法制备少量CuCl:取10mL 0.2mol/L CuCl2溶液,加入0.128g铜屑和36.5%的浓盐酸(密度为1.2g/mL)3mL,在密闭容器中加热,充分反应后,得到无色溶液A;将溶液A全部倾入水中,可得到白色的氯化亚铜沉淀。
已知溶液A中只含氢离子和两种阴离子(不考虑水的电离),其中,n(H+)=0.036mol、n(Cl–)=0.032mol。请通过分析和计算,确定溶液A中另一阴离子的化学式和物质的量。
(3).由CO2、O2、CO、N2组成的混合气体1.008L,测得其密度为1.429g/L,将该气体依次通过足量的30%KOH溶液、氯化亚铜氨溶液(可完全吸收O2和CO) (假定每一步反应都能进行完全),使上述液体分别增加0.44g、0.44g(体积和密度均在标准状况下测定)。
①该混合气体的摩尔质量是 g/mol;混合气体中n(CO2): n(CO和N2) = 。
列式计算:
②混合气体中CO的质量是多少?
③最后剩余气体的体积是多少?
为测定某碳酸钠样品的纯度,取一定质量碳酸钠样品投入到40mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成二氧化碳气体224mL(标准状况下)。计算:
(1)该碳酸钠样品中碳酸钠的质量是。
(2)盐酸的物质的量浓度是。
CaCO3是一种难溶物质,其Ksp=2.8×10-9 , 先将等体积的Na2CO3溶液与CaCl2溶液混合,若Na2CO3溶液的浓度为2×10-4mol·L-1,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为多少?(写出计算过程)
将7.8 g镁铝合金加到足量的氢氧化钠溶液, 充分反应放出气体6.72 L(标准状况下)。请计算
(1)合金中镁的物质的量;
再将7.8 g该镁铝合金与500 mL硫酸溶液恰好完全反应,请计算
(2)原硫酸物质的量浓度。
把20.95g干燥的氯酸钾与二氧化锰的混合物装入大试管中,加热到质量不变为止,剩余固体为16.15g,则:
(1)求生成的气体在标态下的体积
(2)剩余固体各成分的物质的量
(3)向剩余固体中加入过量的浓硫酸,全部氯元素成为两种含氯的混合气体,通入过量的碘化钾溶液,生成的碘被0.02mol Na2S2O3吸收,则生成的两种气体的体积(标态)是多少升?(已知:2Na2S2O3 +I2 → Na2S4O6+2NaI)
钢铁是最重要、用量最大的金属材料之一。完成下列计算:
(1).生产1吨含铁96%的生铁,至少需要氧化铁含量70%的赤铁矿(杂质不含铁)_____吨。(计算结果保留2位小数)
(2).工业炼铁用一氧化碳还原氧化铁时会发生如下一系列反应:
3Fe2O3+CO→2Fe3O4+CO2 Fe3O4+CO→3FeO+CO2 FeO+CO→Fe+CO2
某次实验中,用CO还原4.80 g氧化铁,当固体质量变成4.56 g时,测得此固体中只存在2种氧化物。通过计算确定此固体可能的成分和它们的物质的量之比。
(3).为了测定某碳素钢(假设只含铁和碳)的含碳量,将10.000 g钢样完全溶解于过量的热浓硝酸中,产生了0.300 mol气体(假设气体全部逸出,N2O4已折算为NO2)。气体用50.00 mL 12.00 mol/L的NaOH溶液完全吸收后,只生成两种盐,溶液蒸干后得到不含结晶水的固体32.664 g。计算:
①钢样的含碳量。
②(2)参加反应的硝酸的物质的量。
取100 mL Na2CO3和Na2SO4的混合溶液,加过量BaCl2溶液后得到16.84g白色沉淀,沉淀用过量稀HNO3处理质量减少到6.99g,并有气体放出。试计算:
(1)原混合溶液中Na2SO4的物质的量浓度;
(2)产生的气体在标准状况下的体积。
将一份CaCO3粉末放入500mL的盐酸中,恰好完全反应,在标准状况下收集到的CO2气体体积为22.4L,求
1)CaCO3的质量。 (2)盐酸物质的量浓度。
将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)按顺序写出OA 段所发生反应的离子方程式_______________________。
(2)加人35mL盐酸时,产生二氧化碳的体积为___________mL
(3)计算原混合物中Na2CO3的质量(要求写出计算过程)
把1L 1.0mol/LCuSO4和1L 0.5mol/LH2SO4溶液混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。计算:
(1)混合液中CuSO4溶液的物质的量浓度;
(2)混合液中H+、SO42-的物质的量浓度
(3)向混合溶液中加入多少克铁粉,可以使溶液质量保持不变
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O, 若产生的氯气在标准状况下的体积为11.2L。试计算:
MnCl2+Cl2↑+2H2O, 若产生的氯气在标准状况下的体积为11.2L。试计算:
(1)参加反应的MnO2的质量。(2分)
(2)反应中被氧化的HCl的物质的量。