取100mL Na 2 CO 3 和Na 2 SO 4 的混合溶液,加入过量BaCl 2 溶液后得到29.02g白色沉淀,用过量稀硝酸处理后沉淀量减少到9.32g,并有气体放出。试计算:
(1)原混和溶液中Na 2 CO 3 和Na 2 SO 4 的物质的量浓度 (2)产生的气体在标准状况下体积。
把铝、铁混合物 1.1 g 溶于200 mL 5 molL -1 盐酸中,反应后盐酸的浓度变为4.6 molL -1 (溶液体积变化忽略不计)。
求:(1)反应中消耗HCl的物质的量。
(2)该混合物中铝、铁的物质的量。
将15.6g Na2O2投入足量水中,充分反应(设能产生的气体全部放出)。
(1)涉及到的化学方程式为 ,15.6g Na2O2在该反应中转移电子的物质的量为 mol。(每空3分,6分)
(2)反应结束时生成的气体在标准状况下为 L。(要计算过程5分)
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL4.40mol/L盐酸中,充分反应后产生896mLH2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。求原混合物中单质铁的质量。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)已知:1/2O2(g)=1/2O2+(g)+1/2e-△H1=587.9kJ/mol K1
PtF6(g)+e-=PtF6-(g)△H2=-771.1kJ/mol K2
O2+PtF6-(s)=O2+(g)+PtF6-(g)△H3=482.2kJ/mol K3
则反应O2(g)+PtF6(g)=O2+PtF6-(s)的△H=________,K=_______(用K1、K2、K3表示)
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)  FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示。
FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示。
①T℃、p Pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是_____。
A.混合气体的平均相对分子质量不再变化
B.容器内压强不再变化
C.v正(CO2)=v逆(FeO)
②T1温度下,向体积为VL的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为_____,平衡时混合气体的密度与起始时气体的密度之比为_______。
(3)在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及特定平衡状态见下表。
2NH3,有关数据及特定平衡状态见下表。
| 容器 |
起始投入 |
达平衡时 |
|||
| 甲 |
2molN2 |
3molH2 |
0molNH3 |
1.5molNH3 |
同种物质的体积分数相同 |
| 乙 |
amolN2 |
bmolH2 |
0molNH3 |
1.2molNH3 |
起始时乙容器中的压强是甲容器的____倍。
将一定质量的镁铝合金投入100 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示。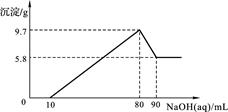
(1)当沉淀达到最大值时,Al(OH)3的质量;
(2)原合金中Mg的质量;
(3)盐酸的物质的量浓度。
碳酸氢钠受热易分解为碳酸钠。现加热5.00 g 碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31 g,求①生成CO2多少L(标准状况)? ②原混合物中碳酸钠的质量分数是多少?
将一定量的pH3和H2的混合气体,依次通过两支加热的硬质玻璃管,第一支装有足量的铜屑,第二支装有足量的CuO,第一支玻璃管中因发生反应:2PH3+3Cu Cu3P2+3H2而增重4.96g;第二支玻璃管反应后质量减轻了5.76g;试求:原混合气体中PH3与H2的体积比。
Cu3P2+3H2而增重4.96g;第二支玻璃管反应后质量减轻了5.76g;试求:原混合气体中PH3与H2的体积比。
回答以下问题:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取已去除表面氧化物的铁钉(碳素钢)6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。写出生成Fe2+所有可能的离子方程式: 。
②乙同学取336ml(标准状况)气体Y通入足量氯水中,发生反应的化学方程式为: 。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为 。
(3)向100ml水中投入Na和Al共16克,充分反应后剩余金属1g。计算放出H2的体积为 升(标准状况下)
(4)向含有0.3mol NaAlO2的溶液中滴加1mol/L HCl,当生成7.8克沉淀时,加入盐酸的体积为 mL
(5)向一定量的Fe、Fe2O3和CuO混合物投入120 ml 2.2 mol/L的硫酸溶液中,充分反应后生成896 mL标准状况下的气体,得不溶物1.28 g,过滤后,向滤液中加入2 mol/L的NaOH溶液,加至40 mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为120 ml) mol/L
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出FeCl3、AlCl3的物质的量浓度各为多少?
把NaOH、MgSO4、Al2(SO4)3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的浊液中逐滴加入2mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图.试回答:
(写出计算过程)
(1)原混合物中的NaOH、MgSO4、Al2(SO4)3的物质的量分别为多少?
(2)Q点HCl溶液加入量是多少mL?
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积为2L的密闭容器中,发生如下反应:N2+ 3H2 2NH3。
2NH3。
(1)若反应进行5min时,测得n(N2) = 1.8mol,n(NH3) = 0.4mol。
计算:①a的值; ②用H2浓度的变化表示的反应速率。
(2)反应达平衡时,混合气体的总物质的量为5.0mol,其中NH3的含量(体积分数)为40%。
计算:上述温度下该反应的化学平衡常数。
某仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为180。取有机物样品1.8g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08g和2.64g。试求该有机物的分子式。