为了除去粗盐中的 Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列五项操作,其中正确的操作顺序是
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量 Na2CO3溶液 ⑤加过量 BaCl2溶液.
| A.①④②⑤③ | B.④①②⑤③ | C.②④⑤①③ | D.⑤②④①③ |
下列各组物质按如图所示转化关系每一步都能一步实现的是

| |
甲 |
乙 |
丙 |
丁 |
| A |
FeCl3 |
FeCl2 |
Fe2O3 |
Fe(OH)3 |
| B |
Cu |
CuO |
CuSO4 |
CuCl2 |
| C |
SO2 |
H2SO4 |
SO3 |
H2S |
| D |
Al(OH)3 |
NaAlO2 |
Al2O3 |
AlCl3 |
A.A B.B C.C D.D
下列叙述正确的是
| A.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 |
| B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同 |
| C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀 |
| D.向FeCl2溶液中通入Cl2反应的离子方程式为:Fe2++Cl2═Fe3++2C1﹣ |
某非金属元素R的氢化物及其氧化物、盐之间具有如下转化关系(部分产物省略):氢化物 B
B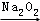 C,下列判断中正确的是
C,下列判断中正确的是
| A.若R是硫元素、则C是Na2SO3 | B.若R是硅元素、则C是Na2Si03 |
| C.若R是碳元素、则C是Na2CO3 | D.若R是氯元素、则C是NaCl |
过氧化钠可作为氧气的来源.常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了14g,反应中有关物质物理量正确的是(NA表示阿伏加德罗常数)
| |
二氧化碳 |
碳酸钠 |
转移的电子 |
| A |
0.5mol |
|
NA |
| B |
|
53g |
0.5mol |
| C |
|
53g |
NA |
| D |
11.2L |
0.5mol |
|
A.A B.B C.C D.D
根据下列热化学方程式
(1)C(s)+O2(g)═CO2(g)△H1=﹣393.5kJ/mol
(2)H2(g)+ O2(g)═H2O(l)△H2=﹣285.8kJ/mol
O2(g)═H2O(l)△H2=﹣285.8kJ/mol
(3)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=﹣870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为
| A.△H=﹣488.3 kJ/mol | B.△H="+244.1" kJ/mol |
| C.△H=﹣996.6 kJ/mol | D.△H="+996.6" kJ/mol |
将50g质量分数为ω1,物质的量浓度为C1的浓硫酸沿玻璃棒加入到VmL水中,稀释后得到质量分数为ω2,物质的量浓度为C2的稀溶液.下列说法中正确的是
| A.若C1=2C2,则ω1<2ω2,V<50mL |
| B.若C1=2C2,则ω1<2ω2,V>50mL |
| C.若ω1=2ω2,则C1<2C2,V=50mL |
| D.若ω1=2ω2,则C1>2C2,V<50Ml |
用水处理金属钠与碳化钙的混合物,有气体放出,此气体在催化剂作用下恰好完全反应,生成另一种气体A.气体A完全燃烧时,需要3.5倍体积的氧气,则金属钠与碳化钙的物质的量之比是
A.2:1 B.1:2 C.4:1 D.1:4
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为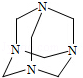
| A.1:1 | B.2:3 | C.3:2 | D.2:1 |
研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2.他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)
| A.0.448L | B.2.240L | C.2.016L | D.无法确定 |
下列说法不正确的是
| A.为了提高生活用水的卫生标准,自来水厂常使用Cl2和FeSO4•7H2O进行消毒、净化,以改善水质 |
| B.硝酸、纯碱、醋酸钾和硅石分别属于酸、碱、盐和氧化物 |
C. 从分类的角度看,混合物、分散系、胶体的从属关系如图所示 |
| D.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极.X、Y、Z三种金属的活动性顺序为
| A.X>Y>Z | B.X>Z>Y | C.Y>X>Z | D.Y>Z>X |
下列说法错误的是
①NaHCO3溶液加水稀释, 的比值保持增大
的比值保持增大
②浓度均为0.1mol•L﹣1的Na2CO3、NaHCO3混合溶液:2c(Na+)═3[c(CO32﹣)+c(HCO3﹣)]
③在0.1mol•L﹣1氨水中滴加0.lmol•L﹣1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH﹣)=l0﹣amol•L﹣1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32﹣)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH﹣)+c(H2S)+c(HS)
| A.①④ | B.②⑤ | C.①③ | D.②④ |
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:四种元素的电子层数之和为10,且它们分别属于连续的四个主族;四种元素的原子中半径最大的是X原子.下列说法正确的
| A.四种元素中有两种元素在第二周期 |
| B.W所在主族元素的原子次外层电子数可能为2或8,不可能为18 |
| C.X、Y、Z的最高价氧化物对应的水化物两两之间能反应 |
| D.工业上获得X、Y单质的方法主要是电解其熔融的氯化物 |