国际石油价格多次上涨,为解决能源危机,现在全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油.已知热化学方程式: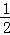 C2H5OH(l)+
C2H5OH(l)+ O2(g)=CO2(g)+
O2(g)=CO2(g)+ H2O(l)△H=﹣683.4kJ/mol.下列有关说法正确的是
H2O(l)△H=﹣683.4kJ/mol.下列有关说法正确的是
| A.乙醇汽油是一种清洁能源,燃烧不会产生任何污染 |
| B.在25℃、101KPa时,生成1mol水时放出683.4kJ的热量 |
| C.乙醇的燃烧热为683.4kJ/mol |
| D.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=﹣1366.8kJ/mol |
生产液晶显示器过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
| 化学键 |
N≡N |
F﹣F |
N﹣F |
| 键能/KJ•mol﹣1 |
941.7 |
154.8 |
283.0 |
下列说法中正确的是
A.过程N2(g)→2N(g)放出能量
B.过程N(g)+3F(g)→NF3(g)放出能量
C.反应N2(g)+3F2(g)→2NF3(g)的△H>0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
已知299K时,合成氨反应N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.0kJ/mol,将此温度下的1mol N2和3mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
| A.一定小于92.0 kJ | B.一定等于92.0 kJ |
| C.一定大于92.0 kJ | D.不能确定 |
反应A(g)+2B(g)=C(g)的反应过程中能量变化如图所示.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.下列相关说法正确的是
| A.该反应是吸热反应 |
| B.催化剂改变了该反应的焓变 |
| C.催化剂降低了该反应的活化能 |
| D.该反应的焓变△H=﹣510kJ.mo1﹣1 |
已知热化学方程式:
H2O(g)═H2(g)+ O2(g)△H=+241.8kJ/mol
O2(g)△H=+241.8kJ/mol
H2(g)+ O2(g)═H2O(1)△H=﹣285.8kJ/mol
O2(g)═H2O(1)△H=﹣285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是
| A.吸热44kJ | B.吸热2.44KJ | C.放热44kJ | D.放热2.44KJ |
下列叙述正确的是
A. O2和 O2和 O2互为同素异形体,性质相似 O2互为同素异形体,性质相似 |
| B.水电站把机械能转化为电能,而核电站把化学能转化成电能 |
| C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| D.C(石墨,s)=C(金刚石,s)△H>0,所以石墨较稳定 |
下列说法正确的是
| A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而增大有效碰撞的次数 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
| C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
| D.催化剂不影响反应活化能但能增大单位体积内活化分子的百分数,从而增大反应速率 |
在298K、100kPa时,已知:2H2O(g)=O2(g)+2H2(g)△H1
Cl2(g)+H2(g)=2HCl(g )△H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是
| A.△H3=△H1+2△H2 | B.△H3=△H1+△H2 |
| C.△H3=△H1﹣2△H2 | D.△H3=△H1﹣△H2 |
下列说法或表示法正确的是
| A.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多 |
| B.需要加热的反应说明它是吸热反应 |
| C.在稀溶液中:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3 kJ/mol,若将含0.5 mol H2SO4的稀硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
| D.1 mol S完全燃烧放热297.3 kJ,其热化学方程式为:S+O2═SO2△H=﹣297.3 kJ/mol |
向500mL bmol/L稀硝酸中加入等物质的量的铁粉和铜粉的混合物18g,充分反应(设HNO3只被还原成NO).下列有关该反应的判断正确的是
| A.若铜有剩余,则向反应后的溶液中再滴加硫酸,铜也不能溶解 |
| B.若金属全部溶解,则反应后的溶液中一定含有Cu2+、Fe3+离子 |
| C.若铁粉全部转化为Fe2+离子,则b的值为0.8 |
| D.若反应后的溶液中n(Fe3+):n(Fe2+)=3:2,则产生的NO为5152 mL(标准状况) |
下列除去有关物质中杂质的方案中,正确的是
| 选项 |
物质(括号内为杂质) |
除去杂质使用的试剂 |
除去杂质的方法 |
| A |
Cl2气(HCl气) |
NaOH溶液,浓硫酸 |
洗气 |
| B |
NH4Cl溶液(FeCl3) |
NaOH溶液 |
过滤 |
| C |
Na2CO3固体(NaHCO3) |
﹣﹣﹣﹣ |
灼烧 |
| D |
I2 (H2O) |
CCl4 |
蒸馏 |
A.A B.B C.C D.D
下列说法不正确的是
| A.钠和钾的合金可用于快中子反应堆作热交换剂 |
| B.可用超纯硅制造的单晶硅来制造计算机的芯片 |
| C.实验室用二氧化锰和浓盐酸共热制取少量氯气 |
| D.氢氧化钠溶液要盛放在磨口玻璃塞的试剂瓶里 |
下列说法正确的是
| A.用丁达尔效应鉴别氢氧化铁胶体和氯化铁溶液 |
| B.因为SO2有漂白性,所以它可使紫色石蕊溶液褪色 |
| C.氯化钠溶液在电流作用下电离成Na+离子和Cl﹣离子 |
| D.等质量的碳酸钠和碳酸氢钠与足量盐酸反应时,碳酸钠产生的CO2多 |
下列离子方程式书写正确的是
| A.氯气溶于水:Cl2+H2O═2H++Cl﹣+C1O﹣ |
| B.溴化钠溶液与氯气反应:2Br﹣+Cl2═2Cl﹣+Br2 |
| C.氢氧化钡溶液与稀硫酸反应:H++SO42﹣+Ba2++OH﹣═H2O+BaSO42﹣↓ |
| D.碳酸钙加入过量的盐酸中:CO32﹣+2H+═CO2↑+H2O |
用NA表示阿伏加德罗常数的值.下列说法正确的是
| A.常温常压下,l1.2 LHCl中含有的分子数目为0.5NA |
| B.NA个氢分子和NA个氧分子的质量比为1:16 |
| C.标准状况下,22.4 L水中含有的分子数目为NA |
| D.1 molCl2与足量的铁反应转移的电子数目是NA |