设NA为阿伏加德罗常数的值。下列说法正确的是
| A.71g氯气中氯原子数为 NA |
| B.标准状况下,22.4 LNH3所含的电子数为10NA |
| C.5.6g Fe在足量氯气中燃烧转移的电子数为2NA |
| D.标准状况下,11.2 L H2O中含有分子的数目为0.5NA |
下列离子方程式正确的是
| A.铜和稀硝酸的反应:Cu2++4H++2NO3-=Cu2++2NO2↑+2H2O |
| B.氯化铁腐蚀印刷电路板:Fe3++Cu = Fe2++Cu2+ |
| C.氯化铝溶液加入氨水:Al3++3OH-= Al(OH)3↓ |
D.实验室制氯气:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
完成下列实验所选择的装置或仪器不正确的是
| |
A |
B |
C |
D |
| 实验 |
分离水和酒精 |
用铵盐和碱制取NH3 |
用排空气法收集NO2 |
用自来水制取蒸馏水 |
| 装置 或 仪器 |
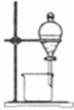 |
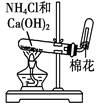 |
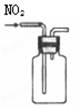 |
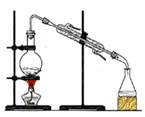 |
在无色透明强酸性溶液中,能大量共存的离子组是
| A.K+、MnO4-、Mg2+、SO42- | B.K+、Na+、Cl-、CO32- |
| C.Zn2+、Al3+、NO3-、Cl- | D.Na+、Fe2+、NO3-、SO42- |
下列说法正确的是
| A.铵盐不稳定,受热分解都产生氨气 |
| B.N2是空气中的主要成分之一,雷雨时可直接转化为NO2 |
| C.由于浓硫酸有强氧化性,因此不能用铁罐贮存浓硫酸 |
| D.Cl2与石灰乳反应可以制得含氯漂白剂 |
下列关于容量瓶的使用方法中,正确的是
| A.使用前检查是否漏水 | B.溶液未冷却即注入容量瓶中 |
| C.容量瓶可长期存放溶液 | D.在容量瓶中直接溶解固体 |
下列叙述不正确的是
| A.碳酸钠可以用于治疗胃酸过多 |
| B.过氧化钠可做航天员的供氧剂 |
| C.金属钠有强还原性,能和硫酸铜溶液反应,但不能析出金属铜 |
| D.为使面包松软可口可用碳酸氢钠做发泡剂 |
为了使Al2(SO4)3中的Al3+完全沉淀,适宜用到的试剂是
| A.NaOH溶液 | B.Ba(OH)2溶液 | C.氨水 | D.BaCl2溶液 |
下列试剂保存正确的是
| A.氯水保存在棕色细口瓶中 | B.NaOH保存在具有玻璃塞的细口瓶中 |
| C.金属钠保存在CCl4中 | D.氢氟酸保存在玻璃塞的细口瓶中 |
下列实验现象与氧化还原反应有关的是
| A.NH3使湿润的红色石蕊试纸变蓝 |
| B.向硅酸钠溶液中滴加适量稀盐酸,有透明的凝胶形成 |
| C.将氯水长期放置,黄绿色消失 |
| D.向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
化学与生活、社会密切相关。下列说法正确的是
| A.正常雨水的pH值为7.0,酸雨的pH值小于7.0 |
| B.亚硝酸盐常做食品防腐剂,可以大量添加于食物中 |
| C.自然界中的固氮作用对植物的生长有害无益 |
| D.大量燃烧化石燃料是造成雾霾天气的重要原因之一 |
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
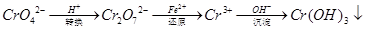
己知转化过程中的反应为:2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是( )
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是( )
| A.转化过程中,增大c(H+),平衡向正反应方向移动,CrO42﹣的转化率提高 |
| B.常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5 |
| C.若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g |
| D.常温下转化反应的平衡常数K=104,则转化后所得溶液的pH=1 |