化学家们合成了一种新物质——五星烷,其键线式如图所示(已知:CH2CH=CH2CHO的键线式为: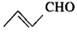 )。下列有关五星烷的说法正确的是
)。下列有关五星烷的说法正确的是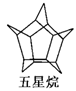
| A.五星烷与乙烷互为同系物 |
| B.五星烷的化学式为C15H20 |
| C.五星烷分子中含有7个五元环 |
| D.五星烷的一氯代物有三种 |
对于苯乙烯(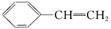 )的下列叙述,其中正确的是
)的下列叙述,其中正确的是
①能使酸性KMnO4溶液褪色 ②可发生加聚反应
③可溶于水 ④可溶于苯中
⑤能与浓硝酸发生取代反应 ⑥所有的原子可能共平面
| A.只有①②④⑤ | B.只有①②⑤⑥ |
| C.①②④⑤⑥ | D.全部正确 |
分析下表中各项的排布规律,按此规律排布第26项应为
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| C2H4 |
C2H6 |
C2H6O |
C2H4O2 |
C3H6 |
C3H8 |
C3H8O |
C3H6O2 |
C4H8 |
C4H10 |
A.C7H16 B.C7H14O2 C.C8H18 D.C8H18O
等物质的量浓度的下列五种溶液:①CH3COOH ②(NH4)2CO3 ③NaHSO4 ④NaHCO3⑤Ba(OH)2,溶液中水的电离程度由大到小排列正确的是
| A.⑤③①④② | B.⑤③①②④ | C.②④③①⑤ | D.②④①③⑤ |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH(固体) ②H2O ③HCl ④CH3COONa(固体)
| A.①② | B.②③ | C.③④ | D.②④ |
下列叙述正确的是
| A.100℃纯水在pH=6,所以水在100℃时呈酸性 |
| B.pH=3的盐酸溶液,稀释至10倍后pH>4 |
| C.0.2mol·L-1的醋酸与等体积水混合后pH=1 |
| D.pH=3的盐酸与pH=11的氢氧化钠等体积混合后pH=7 |
实验室有下列试剂,其中必须用带橡胶塞的试剂瓶保存的是
①NaOH溶液;②水玻璃;③Na2S溶液;④Na2CO3溶液;
⑤NH4Cl溶液;⑥澄清石灰水;⑦浓HNO3;⑧浓H2SO4
| A.①⑥ | B.①②③④⑥ | C.①②③⑥⑦⑧ | D.⑤⑦⑧ |
将足量的铜片与100ml、18mol/L浓硫酸加热充分反应,收集到标准状况下的SO2气体VL。下列对此反应的有关说法中错误的是
| A.该反应体现了浓硫酸的酸性和强氧化性 | B.参加反应的铜为0.9mol |
| C.反应结束后两种反应物均有剩余 | D.被还原的硫酸为V/22.4mol |
某铁的“氧化物”样品,用5mol/L的盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中Fe2+全部转化为Fe3+。该样品可能的化学式是
| A.Fe2O3 | B.Fe3O4 | C.Fe4O5 | D.Fe5O7 |
ClO2是一种消毒杀菌效率高,二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
| A.1mol KClO3参加反应有2mol电子转移 | B.H2C2O4在反应中被还原 |
| C.还原性:H2C2O4 > ClO2 | D.ClO2是氧化产物 |
下列叙述正确的是
| A.NaCl的摩尔质量是58.5g |
| B.将40g氢氧化钠溶解在1L水中可配制物质的量浓度为1mol/L的氢氧化钠溶液 |
| C.气体摩尔体积指lmol任何气体所占的体积约为22.4L |
| D.10毫升1mol/L氯化铝溶液与50毫升3mol/L氯化钠溶液中所含氯离子物质的量浓度相等 |
只用一种试剂可以区别Na2SO4、MgCl2、FeCl2、A12(SO4)3、CuSO4五种溶液,这种试剂是
| A.氨水 | B.NaOH溶液 | C.硫酸 | D.NaNO3溶液 |
下列各组物质中,因反应物用量不同而发生不同化学反应的是
| A.Cu与硝酸 | B.SO2与NaOH溶液 | C.Na与O2 | D.Fe与Cl2 |
下列反应的离子方程式正确的是
A.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O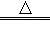 Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |
| B.向盐酸中滴加氨水:H++OH﹣═H2O |
| C.金属钠与水反应:2Na + 2H2O=2Na+ +2OH- +H2↑ |
| D.用FeCl3溶液腐蚀印刷电路铜板:Fe3++ Cu= Fe2++ Cu2+ |
在下列溶液中通入CO2至过量,原溶液一直保持澄清的是
| A.硅酸钠溶液 | B.氯化钡溶液 | C.石灰水 | D.饱和碳酸钠溶液 |