某工厂的废液经测定其主要含有乙醇,此外还有丙酮、乙酸和乙酸乙酯。以上各物质的沸点如下:
| 物质 |
丙酮 |
乙酸乙酯 |
乙醇 |
乙酸 |
| 沸点/℃ |
56.2 |
77.06 |
78 |
117.9 |
现拟通过下列步骤回收乙醇和乙酸:
①向废液中加入甲溶液;②将混合液放入蒸馏器中缓缓加热;③收集温度在70℃~85℃之间的馏出物;④排出蒸馏器中的残液,冷却后向其中加入乙溶液(过量),然后再放入蒸馏器中进行蒸馏,收集馏出物.
可选用试剂:A. 烧碱溶液 B. 浓硫酸 C.饱和食盐水 D. 浓盐酸
请回答下列问题:
(l)乙醇的沸点比丙酮沸点高的主要原因是
(2)加入甲溶液是_________,(填A B C D序号),涉及到的反应方程式:
(3)在70℃~85℃时馏出物的主要成分为________________________。
(4)在步骤④中加入过量的乙溶液是_________。(填A B C D序号),
(5)最后蒸馏的温度控制在____________。
(6)在蒸馏操作中,仪器选择及安装都正确的是:__________(填标号)
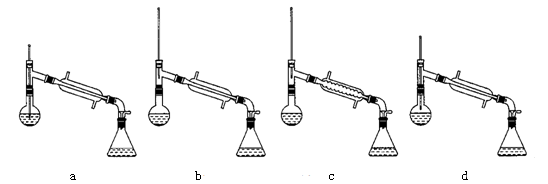
如果蒸馏前忘记加沸石,液体温度已接近沸点时,应该如何处理?___________________
海水开发利用的部分过程如图所示。下列说法错误的是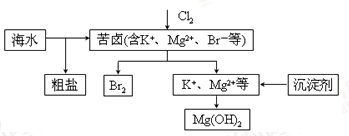
| A.向苦卤中通入Cl2是为了提取溴 |
| B.粗盐可采用除杂和重结晶等过程提纯 |
| C.工业生产中常选用NaOH作为沉淀剂 |
| D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
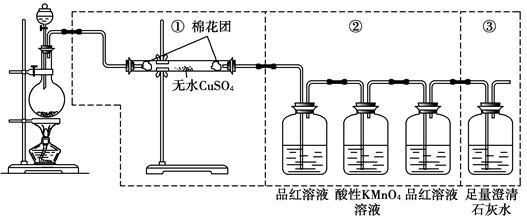
(1)装置中①、②、③可以检验出的物质是① ____,②____________,③_____________。
(2)浓硫酸与木炭粉反应的化学方程式:____________________。
(3)②中第一瓶品红溶液的作用是_________________,第二瓶品红溶液的作用是_________________,酸性KMnO4溶液的作用是__________________。
(4)证明产生的气体中含有CO2的现象是:___________________。
大多数非金属元素有含氧酸根离子,某些金属元素也有含氧酸根离子:
MnO4-、MnO42-、Cr2O72-等。某无机盐M是一种优良的氧化剂,为确定其化学式,某小组设计并完成了如下实验:
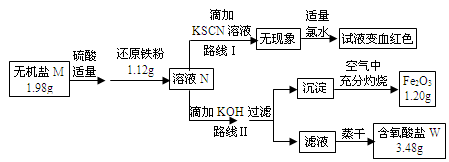
已知:
①无机盐M仅由钾离子和一种含氧酸根组成,其原子个数比为2:1:4
②如图中,将1.98g该无机盐溶于水,滴加适量稀硫酸后,再加入1.12g还原铁粉,整个过程无气体生成,恰好完全反应得混合溶液N.
③该小组同学将溶液N分为二等份,分别按路线Ⅰ、路线Ⅱ进行实验.
④在路线Ⅱ中,首先向溶液N中滴加适量KOH至元素X刚好沉淀完全,过滤后将沉淀在空气中充分灼烧得纯净的Fe2O3粉末1.20g;再将滤液在一定条件下蒸干,只得到3.48g纯净的不含结晶水的正盐W.
请按要求回答下列问题:
(1)由路线Ⅰ的现象可知,溶液N中含有的阳离子是 .
(2)由实验流程图可推得,含氧酸盐W的化学式是 ;由路线Ⅱ可知,1.98g无机盐M中所含钾元素的质量为 g.
(3)无机盐M与1.12g还原铁粉恰好完全反应生成溶液N的化学反应方程为 .
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物.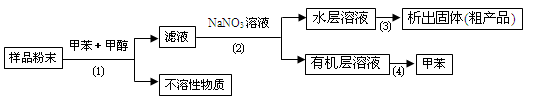
下列说法错误的是
| A.步骤(1)需要过滤装置 | B.步骤(2)需要用到分液漏斗 |
| C.步骤(3)需要用到坩埚 | D.步骤(4)需要蒸馏装置 |
对于某些离子的检验及结论正确的是
| A.向某溶液中滴加NaOH溶液并加热,用湿润的蓝色石蕊试纸于试管口以检验NH4+ |
| B.加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42- |
| C.某待测液焰色反应呈黄色,则待测液中一定不含有K+ |
| D.某溶液中加入KSCN后,溶液无变化,再加入H2O2后,溶液变成血红色,说明原溶液中一定含有Fe2+ |
下列说法正确的是
| A.FeCl3溶液需存放在加有少量铁粉的试剂瓶中,防止变质 |
| B.食盐水中Ca2+、SO42-等杂质的去除,应先加Na2CO3溶液,后加BaCl2溶液 |
| C.用四氯化碳来萃取碘水中的I2,有机层应从分液漏斗的下端放出 |
| D.用BaCl2溶液来检验暴露在空气中的Na2SO3样品是否变质 |
用下列实验装置进行相应实验,装置正确且能达到实验目的的是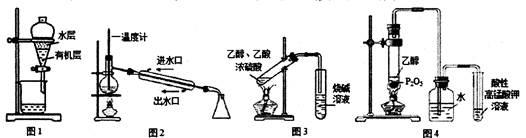
| A.用图1所示装置分离用苯萃取碘水后已分层的有机层和水层 |
| B.用图2所示装置进行石油的分馏 |
| C.用图3所示装置制备少量的乙酸乙酯 |
| D.用图4所示装置制取乙烯并验证其易被氧化 |
有一包白色固体粉末,可能含有K2SO4、Na2CO3、NH4Cl、BaCl2、CuSO4中的一种或几种,按以下步骤进行实验:
①取少量固体粉末加到足量水中,得到无色溶液;
②取①中溶液少量继续往其中加入足量稀硫酸,有气泡产生;
③继续向②中的溶液加Ba(NO3)2溶液,有白色沉淀生成;
④取①中溶液少量,加入NaOH溶液并加热,产生刺激性气味的气体,并用湿润的红色石蕊试纸检验气体,试纸变蓝。
根据以上事实判断:
(1)肯定存在的是______________。
(2)肯定不存在的是____________。
(3)不能确定是否存在的是_____________。请简述证明该物质是否存在的实验方案(实验方法、现象、结论)__________________________。
(4)写出上述实验④中产生刺激性气味反应的离子方程式:_____________________。
某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从废水中回收硫酸亚铁和金属铜。请根据流程图回答下列问题,完成回收的简单实验方案。
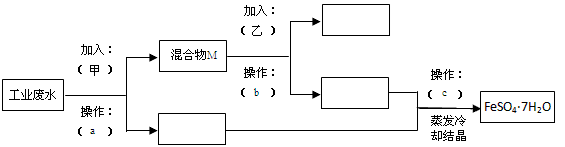
(1)操作a的名称为__________。
(2)加入的甲、乙物质分别为________、_________。
A.浓H2SO4 B.稀H2SO4 C.Fe粉 D.稀HCl
(3)操作c过程中用到的仪器是_______________。
A.坩埚 B.蒸发皿 C.玻璃棒 D.酒精灯
(4)Fe2+具有较强的还原性,易变质,检验产品FeSO4∙7H2O变质的方法是_____________________。
(5)为方便处理废液,检测人员取废水样10mL,做相应如图流程处理。加入加入甲物质质量为4.2g,最终得到FeSO4∙7H2O27.8g(不考虑处理过程中的损失),则原试样中c(Fe2+)=__________。
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 |
实验 |
现象 |
结论 |
| A |
在溶有AlCl3和MgCl2的溶液中逐滴加入NaOH溶液至过量 |
先生成白色沉淀,后沉淀部分溶解 |
金属性:Na>Mg>Al |
| B |
向某废液中先加入烧碱溶液,后加入葡萄糖溶液 |
无砖红色沉淀产生 |
废液中不含Cu2+ |
| C |
向盛有Fe(NO3)2溶液的试管中滴入H2SO4溶液 |
试管口出现红棕色气体 |
溶液中NO3-被Fe2+还原为NO2 |
| D |
加热分解钠盐X,将产生的气体通入硝酸酸化的BaCl2溶液中 |
实验开始立即产生白色沉淀 |
X可能是NaHCO3 |
下列有关离子的检验方法和判断正确的是
| A.向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+ |
| B.向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+ |
| C.向某溶液中滴加足量稀HCl,产生气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- |
| D.用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色,说明原溶液中不含K+ |