(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
以下是25℃时几种难溶电解质的溶解度:
| 难溶电解质 |
Mg(OH) 2 |
Cu(OH) 2 |
Fe(OH) 2 |
Fe(OH) 3 |
| 溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子,例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为____________(填化学式)而除去.
(2)①中加入的试剂应该选择________为宜,其原因是_________________.
(3)②中除去Fe3+所发生的总反应的离子方程式为_____________________.
(4)下列与方案③相关的叙述中,正确的是________(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
某地煤矸石经预处理后含SiO2、Al2O3、Fe2O3,一种综合利用煤矸石制取绿矾(FeSO4·7H2O)的工艺流程如下图所示。
(1)过滤操作需要用到的玻璃仪器除了烧杯、玻璃棒还有_____________。
(2)写出所选试剂X、Y的化学式:X_______________,Y_____________。
(3)滤液B中含的阴离子有_____________(写离子符号)。
(4)滤渣SiO2可制取木材防火剂,该防火剂的化学式为______________。
(5)由溶液D转化为溶液E的离子方程式为:______________。
(6)根据图中数据,计算出原40g煤矸石中Fe2O3的质量分数为_____________。(假设适量均为恰好反应)
某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下:
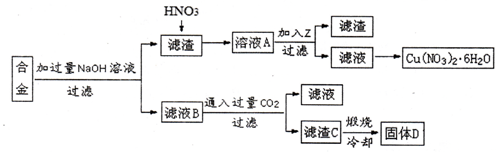
已知:Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7。
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式 。
(2)写出滤液B中通入过量CO2的化学方程式 。
(3)加入Z的作用是调节溶液的pH,除去溶液中的Fe3+,pH范围应为 ;下列可作为试剂z的是 。(填序号)
a.铜粉 b.氨水 c.氧化铜 d. 硫酸铜
(4)某同学为了测定硝酸铜晶体的结晶水含量,完成操作步骤:称量样品、加热、 、称量CuO质量、 、计算。
(5)滤渣C的质量是10g,煅烧后得到固体D6.90g,则滤渣C中氢氧化铝的质量分数为 。(保留两位小数)
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高,可能的原因是 。(写一条即可)
在某澄清溶液中,可能存在下列几种离子:H+、K+、Ba2+、SO42-、I-、CO32-。取该溶液进行下列实验:①用pH试纸检验,该溶液呈强酸性;②取200mL溶液加入少量氯水和少量CCl4,振荡后静置,CCl4层呈紫色;③另取部分溶液逐滴加入NaOH溶液,当溶液呈碱性时,再加入Na2CO3溶液,有白色沉淀生成。
(1)根据上述实验现象,推断原溶液中肯定存在的离子是_____________,肯定不存在的离子是_______,可能存在的离子是____________。
(2)若步骤②中消耗0.1molCl2,则溶液中与Cl2反应的离子的物质的量浓度为________________。
(3)写出实验③中生成白色沉淀的离子方程式:____________________。
工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
(1)Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是:_____________。
(2)沉淀M中除含有泥沙外,一定还含有_________(填化学式),生成固体N反应的化学方程式为_________。
(3)滤液X中,含铝元素的溶质的化学式为___________,它属于__________(填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入___________(填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为__________________________。
(5)滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有__________________。
海水提镁的工业流程如下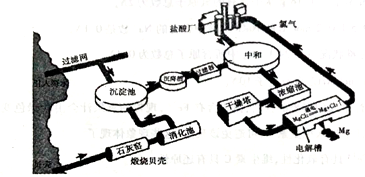
(1)煅烧贝壳时,贝壳的主要成分发生了什么变化?__________(用化学方程式表示)。
(2)从海水中的镁离子到金属镁,主要经历了三步化学变化,写出前两步反应的化学反应方程式:
①______________;②_______________。
③第三步反应(MgCl2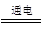 Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
(3)在生产过程中采用了一些措施提高经济效益,请写出一点____________________。
(4)输送氯气的管道需要定期检查是否漏气,管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下):2NH3+3Cl2=N2+6HCl。下列说法中正确的是__________。
A.用该方法检验管道泄漏处会产生白烟
B.管道泄漏处会闻到刺激性气味
C.该反应中的HCl是氧化产物,N2是还原产物
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+ 5种离子,现进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀生成。
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有的离子是 ,一定不含的离子是__________,还有一种离子不能确定是否存在,要检验这种离子的实验方法是 。
现有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3、Na2SO4现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀产生:
②向①的悬浊液中加入过量稀盐酸,白色沉淀部分溶解,并有气泡放出:
③取少量②的上层清液滴入硝酸银溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题:
(1)判断原白色粉末中肯定含有, ,可能含有 。
(2)写出上述实验中一定发生的有关反应的离子反应方程式: 。
榴石矿石可以看作由CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如下: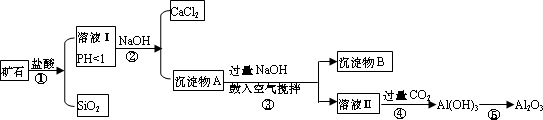
(1)溶液Ⅰ中除了Ca2+外,还可能含有的金属阳离子有__________________;
(2)步骤③中NaOH参加反应的离子方程式____________________________,鼓入空气并充分搅拌的目的是(用化学方程式表示)____________________;
(3)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是_____________________。
某溶液含Cl-、SO42-、CO32-三种阴离子,欲依次检验出此三种阴离子且只取用一次该溶液,则加入的检验试剂依次分别是 (写化学式);写出最后检验出的离子与所加试剂反应的离子方程式 。
除去下列不纯物质中的少量杂质(括号内为杂质),请填入适当的试剂
(1)Cu(Al)_________________(2)Fe2O3(Al2O3)___________________
(3)NO(NO2)__________________(4)NaCl溶液(Na2CO3)_______________
除杂质:所选试剂都填化学式
(1) 除去混入NaCl溶液中少量NaHCO3杂质的试剂是 ,离子方程式为 。
(2) 除去FeCl2溶液中混入的FeCl3溶液杂质用试剂是 ,离子方程式为 。
(3)除去Mg粉中混有的少量Al杂质的试剂是 ,离子方程式为 。
(4)除去NaHCO3溶液中混有的少量Na2CO3 杂质的试剂是 ,离子方程式为 。
(1)0.5 mol H2O的质量为 ,其中含有 个水分子,共有 个原子。
(2)在下列提供的试剂中,选择合适的试剂除去下表中各混合物的杂质(括号内物质为杂质),并按要求填写空格。
| A.NaOH溶液 | B.稀盐酸 | C.氯水 | D.溴水 |
| 混合物(括号内为杂质) |
除杂试剂(填序号) |
反 应 离 子 方 程 式 |
| ① Cu (CuO) |
|
|
| ② NaBr (NaI) |
|
|
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。从溶液中将Cu2+、Fe2+、Fe3+沉淀为氢氧化物所需pH分别为6.4,6.4,3.7。现有某氯化铜晶体中含有FeCl2杂质,为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图所示步骤进行提纯。

回答下列问题:
(1)最适合本实验的氧化剂是_____________。(填序号)
a.K2Cr2O7 b.H2O2 c.NaClO d.KMnO4
加入氧化剂对应的离子方程式为:_____________________________。
(2)物质Y是______________(填名称)。
(3)本实验加碱沉淀法能不能达到目的?______________原因是_________________________。
(4)最后能否直接蒸发结晶?若不能,应如何操作? _________________。
(5)加氧化剂的目的是__________________________。
(6)除去Fe3+的有关离子方程式_______________________________。