某溶液中可能存在下列离子:NH4+、Fe2+、Cl-、SO42-、CO32-中的一种或几种,某同学为了检验它们的存在,进行了如下实验:
①取少量该溶液加入过量的Ba(NO3)2溶液,产生白色沉淀,过滤,得沉淀和滤液;
②向①的沉淀中加入足量的稀硝酸,发现沉淀不溶解;
③向①的滤液中加入硝酸银溶液,未见白色沉淀;
④再取少量原溶液加入2滴KSCN溶液,无明显现象,继续加入氯水,溶液立即变为血红色。
(1)则原溶液中一定存在的离子是______________;
(2)一定不存在的离子是______________;
(3)可能存在的离子是_________,为进一步确定该离子是否存在,该同学还应补做的实验是___________。
有一包白色固体粉末,可能含有K2SO4、Na2CO3、NH4Cl、BaCl2、CuSO4中的一种或几种,按以下步骤进行实验:
①取少量固体粉末加到足量水中,得到无色溶液;
②取①中溶液少量继续往其中加入足量稀硫酸,有气泡产生;
③继续向②中的溶液加Ba(NO3)2溶液,有白色沉淀生成;
④取①中溶液少量,加入NaOH溶液并加热,产生刺激性气味的气体,并用湿润的红色石蕊试纸检验气体,试纸变蓝。
根据以上事实判断:
(1)肯定存在的是______________。
(2)肯定不存在的是____________。
(3)不能确定是否存在的是_____________。请简述证明该物质是否存在的实验方案(实验方法、现象、结论)__________________________。
(4)写出上述实验④中产生刺激性气味反应的离子方程式:_____________________。
我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:
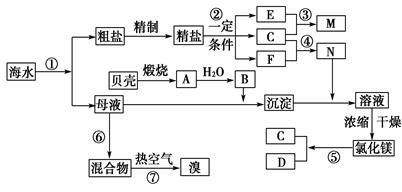
Ⅰ.(1)写出N的化学式_________________________;
(2)写出反应②的化学方程式_________________________。
Ⅱ.粗盐中含有Ca2+、Mg2+、
SO42-等杂质,精制时所用的
试剂为:①盐酸 ②氯化钡溶液
③氢氧化钠溶液 ④碳酸钠溶液,以上试剂添加的顺序可以为____________。
A.②③④① B.③④②① C.④③②① D.③②④①
Ⅲ.提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2。
(1)若用来提取Mg,根据上述提取Mg的流程,没有涉及到的反应类型是____________。
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(2)若用来提取Br2,反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是____________。
A.从外地购买 B.在当地新建生产厂
C.从本厂生产烧碱处循环 D.从本厂生产镁单质处循环
(3)母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2 乙:母液先提取Br2,后提取Mg
请你判断哪个更合适?______(填“甲”或“乙),理由是____________________________ ___。
Ⅰ.现有Al3+、NH4+、CO32—、HCO3— 等离子,回答下例问题:
①在强酸性条件下能够存在的离子是 ;
②在强碱性条件下能够存在的离子是 ;
③在强酸性和强碱性条件下都不能存在的离子是 。
Ⅱ.由Na+、NH4+、 Ba2+、 Cu2+、 OH—、 Fe3+、 SO42—、 Cl— 等八种离子中的六种两两组成的A、B、C三种化合物(它们不含有共同离子,已知NH4+与OH— 反应有碱性气体生成)。
A.A、B、C均易溶于水,形成无色溶液;
B.将A、B、C三种物质的溶液相互作用时,发现A与B混合后产生有刺激性气味的气体,此气体使湿润红色石蕊试纸变蓝,B与C混合产生白色沉淀,则:
①A、B、C的化学式为:
A、 ;
B、 ;
C、 。
②B+C反应的离子方程式为: 。
A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、 Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol/L A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1)根据以上事实推断A-E的化学式:
A 、B 、C 、E
(2)写出①A溶液呈碱性和③的离子方程式:
①
③ _
A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定。试确定A、B、C、D、X各代表何种溶液,把对应物质的化学式填入下列空白:
A:_______,B:________,C:_______,D:_______,X:_______。
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+、Na+、Al3+、Cu2+ |
| 阴离子 |
OH-、HCO3-、NO3-、SO42- |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象。
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、C的化学式:B ;C 。
(2)写出过量E滴人到C溶液中的离子反应方程式 。
(3)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(4)在A溶液中加澄清石灰水,其离子方程式为 。
Ⅰ.某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
a.取少量溶液,加入KSCN溶液,无明显变化
b.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色
c.向b中所得溶液中加入BaCl2溶液,有白色沉淀生成
d.向b中所得溶液中加入过量浓氨水,仅有红褪色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成
(已知Cu2+与过量浓氨水反应生成四氨合铜离子)请回答下列问题:
(1)该废水一定含有的离子是_____________;
(2)实验b中加入盐酸生成无色气体的离子方程式是________________;
(3)过滤除去d中的蓝色沉淀,调整溶液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-+OH- AlO2-+NH3+N2+H2O(未配平)。若除去0.2molNO3-,消耗铝___g。
AlO2-+NH3+N2+H2O(未配平)。若除去0.2molNO3-,消耗铝___g。
Ⅱ.某混合液中,可能大量含有的离子如下表:
| 阳离子 |
H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 |
Cl-、Br-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示:
(1)该溶液中一定含有的阳离子是_____________,溶液中一定不存在的阴离子是________。
(2)请写出沉淀减少的离子方程式________________________。
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl﹣、SO42﹣、和NO3﹣的分离.实验过程如下图所示:
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X:_______,沉淀A:_______。
(2)上述实验流程中加入过量的Na2CO3的目的是_______。
(3)按此实验方案得到的溶液3中肯定含有_______(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的_______,之后若要获得固体NaNO3需进行的实验操作是_______(填操作名称)。
一种固体物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成。为检验它们,做了以下实验。
(1)将固体物溶于水,搅拌后得到无色透明溶液;
(2)取此溶液适量,向其中滴加过量的硝酸钡溶液,有白色沉淀生成;
(3)过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
试判断:
固体物中肯定有________,肯定没有____________________,可能有________,对可能有的物质,可采用向滤液中滴加________溶液的方法来检验。
有A、B、C、D、E、F六种化合物,它们之间的反应关系如下所示:
① A+B → C+E ② C+NaOH → 蓝色沉淀D + F
③ D A+E ④ F+Ba(NO3)2 → 白色沉淀 + NaNO3
回答下列问题:
(1)写出它们的化学式:A ,E 。
(2)写出①②③④反应的化学方程式,属于离子反应的只写离子方程式。
① ; ② ;
③ ; ④ 。
某溶液X含有H+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下:
(1)通过上述实验过程,一定不存在的离子是________________________。
(2)写出有关离子方程式:步骤①中生成A________________________。
(3)若测得X溶液中c(H+)="5" mol·L-1,则X溶液中_______(填“含”或“不含”)Fe3+,c(Fe3+)=______mol·L-1(若填不含,则不需计算),X溶液中c(C1-)=____________ mol·L-1。
某溶液中可能存在Mg2+、Na+、K+、Al3+、Br-、CO32-、SO32-、Cl-等8种离子中的某几种。现取该溶液进行实验,得到如下现象:
①用铂丝蘸取溶液在无色火焰上灼烧,火焰呈黄色;
②向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
③将②所得溶液分为2份,一份加入足量BaCl2溶液,有白色沉淀生成,另一份加入AgNO3溶液,有白色沉淀生成。
据此可以推断:该溶液肯定存在的离子是______________________________。
有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀.
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是_________,一定不含有的物质是_________,可能含有的物质是_________.(写化学式)
(2)写出各步变化的离子方程式.
①__________________;
②__________________。
已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:Ba2+、H+、K+、NH4+、CO32-、Cl-、OH-、SO42-.将这4种溶液分别标记为A、B、C、D,其相互关系如下:
①向A或D中滴入C,均生成白色沉淀;
②A和B混合加热产生的气体能被D吸收;
③A和D反应生成的气体能被B吸收。
请回答下列问题:
(1)A、B、C、D中电解质的化学式:
A________、B、________C、________D________。
(2)若将B和D混合,反应的离子方程式为______________________。
(3)若将③中生成的气体用过量的B吸收,则反应的离子方程式为___________________。