某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下:

已知:Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7。
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式 。
(2)写出滤液B中通入过量CO2的化学方程式 。
(3)加入Z的作用是调节溶液的pH,除去溶液中的Fe3+,pH范围应为 ;下列可作为试剂z的是 。(填序号)
a.铜粉 b.氨水 c.氧化铜 d. 硫酸铜
(4)某同学为了测定硝酸铜晶体的结晶水含量,完成操作步骤:称量样品、加热、 、称量CuO质量、 、计算。
(5)滤渣C的质量是10g,煅烧后得到固体D6.90g,则滤渣C中氢氧化铝的质量分数为 。(保留两位小数)
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高,可能的原因是 。(写一条即可)

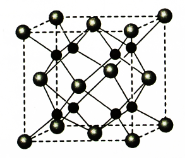
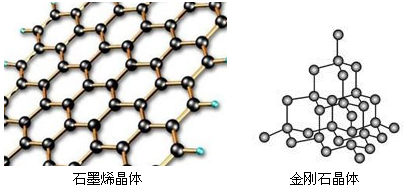
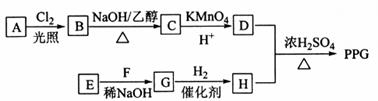
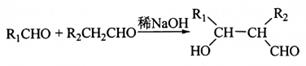 。
。 粤公网安备 44130202000953号
粤公网安备 44130202000953号