中国女药学家屠呦呦获得了2015年诺贝尔生理学或医学奖,以表彰她创新了具有国际影响的世界抗疟药——青蒿素(分子式C15H22O5)其方法是用乙醚作为溶剂,提取青蒿素。这种方法的原理属于
| A.过滤 | B.蒸发 | C.萃取 | D.结晶 |
某地煤矸石经预处理后含SiO2、Al2O3、Fe2O3,一种综合利用煤矸石制取绿矾(FeSO4·7H2O)的工艺流程如下图所示。
(1)过滤操作需要用到的玻璃仪器除了烧杯、玻璃棒还有_____________。
(2)写出所选试剂X、Y的化学式:X_______________,Y_____________。
(3)滤液B中含的阴离子有_____________(写离子符号)。
(4)滤渣SiO2可制取木材防火剂,该防火剂的化学式为______________。
(5)由溶液D转化为溶液E的离子方程式为:______________。
(6)根据图中数据,计算出原40g煤矸石中Fe2O3的质量分数为_____________。(假设适量均为恰好反应)
某溶液含有K+、Fe3+、SO42-、CO32-、I-中的一种或几种。取样,滴加KSCN溶液后显红色。为确定该溶液的组成,还需检验的离子是
| A.K+ | B.I- | C.SO42- | D.CO32- |
下列实验操作中错误的是
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.向碘水中加入适量酒精,可以将碘单质萃取出来 |
| D.蒸发时,当溶液中出现大量晶体时,停止加热余热蒸干 |
在粗盐的提纯实验中,下列说法正确的是
| A.该实验得到的NaCl中无其他任何杂质 |
| B.检验所得NaCl中是否混有BaCl2,可用AgNO3溶液检验 |
| C.该实验基本操作分为溶解、过滤和蒸发三个步骤 |
| D.除去杂质时,不必考虑所加试剂的顺序 |
某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下:
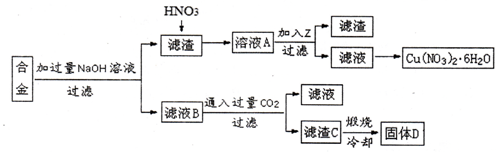
已知:Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7。
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式 。
(2)写出滤液B中通入过量CO2的化学方程式 。
(3)加入Z的作用是调节溶液的pH,除去溶液中的Fe3+,pH范围应为 ;下列可作为试剂z的是 。(填序号)
a.铜粉 b.氨水 c.氧化铜 d. 硫酸铜
(4)某同学为了测定硝酸铜晶体的结晶水含量,完成操作步骤:称量样品、加热、 、称量CuO质量、 、计算。
(5)滤渣C的质量是10g,煅烧后得到固体D6.90g,则滤渣C中氢氧化铝的质量分数为 。(保留两位小数)
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高,可能的原因是 。(写一条即可)
为使溶液中的3种阳离子、A+、B2+、C3+逐一沉淀分离,将含有A+、B2+、C3+离子的水溶液进行如下实验,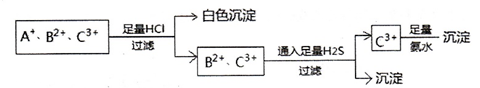
关于三种离子的判断正确的是
| A.Ag+、Fe2+、Al3+ | B.NH4+、Fe2+、Fe3+ | C.Ag+、Cu2+、Fe3+ | D.Ag+、Cu2+、A13+ |
测定硫酸铜晶体(CuSO4·xH2O)中x值的实验过程如下。完成下列填空:
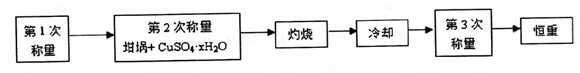
(1)设待测硫酸铜晶体的化学式为CuSO4·xH2O ,则该硫酸铜晶体受热失去全部结晶水的化学方程式为 。
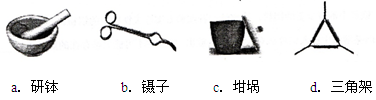
(2)下列是实验中用到的几种仪器,仪器与对应名称正确的是 。(填序号)
(3)“冷却”操作应在 (填仪器名称)中进行,“灼烧”时热源选用的是酒精灯而不是酒精喷灯,理由是 。
(4)恒重操作的目的是 。
(5)测定硫酸铜晶体结晶水含量时,若实验结果偏低,原因可能是 。(填序号)
a.坩埚未完全干燥 b.加热过程中晶体有少量溅失
c.坩埚上沾有受热不分解的杂质 d.加热后未放入干燥器中冷却
(6)下面是某学生实验的一次数据,请完成计算
| 加热前质量 |
加热后质量 |
||
| m1 |
m2 |
m3 |
m4 |
| 11.721g |
22.692g |
18.631g |
a |
①若无需再进行第三次称量,则a的数值范围应为 。
②若加热后坩埚与固体总质量为18.631g,实测值x= (保留两位小数)
③若理论值x=5,则该实验的相对误差是 。
实验题组
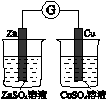
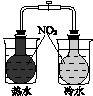
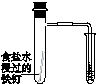
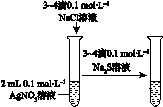
Ⅰ.下图所示的实验,能达到实验目的的是 。
| A |
B |
C |
D |
 |
 |
 |
 |
| 验证化学能 转化为电能 |
验证温度对化学平衡的影响 |
验证铁 发生析氢腐蚀 |
验证AgCl 溶解度大于Ag2S |
Ⅱ.某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,再进行以下实验:
(1)向FeCl3溶液中通入一定量的SO2,反应的离子方程式: ;
(2)检验吸收液中SO42–的方法: ;
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在 ;
假设3:溶液中存在Fe2+ 而不存在H2SO3(二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL L-1KMnO4、0.1moL
L-1KMnO4、0.1moL L-1KSCN溶液、品红溶液。
L-1KSCN溶液、品红溶液。
| 实验步骤 |
预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取 |
(1) 若出现红色,则假设1成立; (2)若未出现红色,则假设2或假设3成立。 |
| 步骤2: |
|
已知下列数据:
| 物 质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
||
| 乙 醇 |
-114 |
78 |
0.789 |
||
| 乙 酸 |
16.6 |
117.9 |
1.05 |
||
| 乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
||
| 浓H2SO4 |
|
338 |
1.84 |
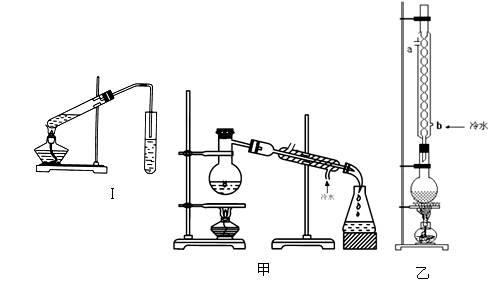
实验室制乙酸乙酯的主要装置如上图I所示,主要步骤为:①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到15mL试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处,③小火加热试管中的混合液;④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;⑤分离出纯净的乙酸乙酯。
请同学们回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是 。
(2)写出该反应的化学方程式 。浓H2SO4的作用是 。
(3)步骤③中,用小火加热试管中的混合液,其原因是: 。
(4)步骤④所观察到的现象 ,写出原因是_______________。
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是________,产物应从_______口倒出,因为______________。
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物)。你认为 装置合理,因为 。
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②在第①步的生成的产物中加入30% H2O2,反应生成CaO2•8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2•8H2O,再脱水干燥得到CaO2。
完成下列填空:
(1)第①步反应的化学方程式为 ________。
(2)生产中可循环使用的物质是 。
(3)检验CaO2•8H2O是否洗净的方法是 ________________ 。
(4)已知CaO2在350℃迅速分解生成CaO和O2。如图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
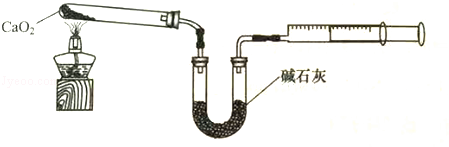
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为 (用字母表示)。过氧化钙的含量也可用重量法测定,需要测定的物理量有 ______ 。
海水开发利用的部分过程如图所示。下列说法错误的是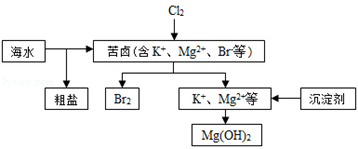
| A.向苦卤中通入Cl2是为了提取溴 |
| B.粗盐可采用除杂、过滤、蒸发结晶等过程提纯 |
| C.工业生产常选用NaOH作为沉淀剂 |
| D.单质溴可用SO2将其还原吸收 |
关于某无色溶液中所含离子的鉴别,下列叙述正确的是
| A.加入Ba(NO3)2溶液生成白色沉淀,加入盐酸后沉淀不消失,则原溶液中一定含有SO42- |
| B.通入Cl2后溶液变黄色,加入淀粉溶液后溶液变蓝,则原溶液中一定有I- |
| C.加入盐酸生成的气体能使饱和的澄清石灰水变浑浊,则原溶液中一定含有CO32- |
| D.加入NaOH溶液并加热产生的气体能使湿润蓝色石蕊试纸变红,则原溶液中一定有NH4+ |