下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
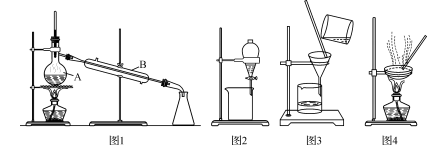
(1)装置图l中A的名称是 ,B的名称是 。
A中一般要加入碎瓷片,其作用是 。装置图4中盛溶液的仪器名称是 。
(2)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

i灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需仪器,将标号字母填写在空白处);
A 烧杯 B 坩埚 C 表面皿 D 泥三角 E 酒精灯
ii步骤③的实验选择上述装置图 (填图的序号);
iii步骤⑤的实验操作名称是_____________;
iV步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是 _,选择上述装置图 (填图的序号)。
下图所示是分离混合物时常用的仪器,从左至右可以进行的混合物分离操作分别是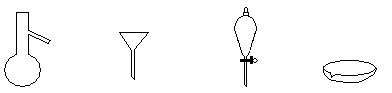
| A.蒸馏、蒸发、萃取、过滤 | B.蒸馏、过滤、萃取、蒸发 |
| C.萃取、过滤、蒸馏、蒸发 | D.过滤、蒸发、萃取、蒸馏 |
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、KCl等混合而成,为检验它们,做了如下实验:
①将固体混合物溶于水,搅拌后得无色透明溶液;
②往此溶液中滴加BaCl2溶液,有白色沉淀生成;
③过滤,将沉淀物置于足量稀硝酸中,发现沉淀全部溶解.
试判断:
(1)固体混合物中肯定有 ,肯定没有 ,可能有 .
(2)写出实验③中的离子方程式: .
(3)对可能有的物质进行确认,把③的滤液做进一步鉴别操作,写出你所设计的实验方案(包括具体操作步骤和实验现象) .
关于海水综合利用问题,下列说法错误的是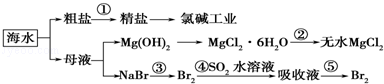
| A.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将电能转化为化学能的过程 |
| B.在过程②中若要获得无水MgCl2不可直接蒸干灼烧 |
| C.除去粗盐中杂质(Mg2+、SO42﹣、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 |
| D.第③④步的目的是为了浓缩富集溴 |
下列关于化学实验基本操作的叙述中,正确的是
| A.加热蒸发时,蒸发皿必须垫石棉网 |
| B.制Fe(OH)3胶体时,将饱和FeCl3溶液加热煮沸 |
| C.分液时,放出分液漏斗下层液体后,再继续放出上层液体 |
| D.蒸馏时,在烧瓶中加入沸石或碎瓷片,以防止液体暴沸 |
中国女药学家屠呦呦获得了2015年诺贝尔生理学或医学奖,以表彰她创新了具有国际影响的世界抗疟药——青蒿素(分子式C15H22O5)其方法是用乙醚作为溶剂,提取青蒿素。这种方法的原理属于
| A.过滤 | B.蒸发 | C.萃取 | D.结晶 |
某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下:
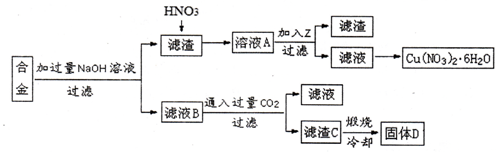
已知:Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7。
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式 。
(2)写出滤液B中通入过量CO2的化学方程式 。
(3)加入Z的作用是调节溶液的pH,除去溶液中的Fe3+,pH范围应为 ;下列可作为试剂z的是 。(填序号)
a.铜粉 b.氨水 c.氧化铜 d. 硫酸铜
(4)某同学为了测定硝酸铜晶体的结晶水含量,完成操作步骤:称量样品、加热、 、称量CuO质量、 、计算。
(5)滤渣C的质量是10g,煅烧后得到固体D6.90g,则滤渣C中氢氧化铝的质量分数为 。(保留两位小数)
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高,可能的原因是 。(写一条即可)
为使溶液中的3种阳离子、A+、B2+、C3+逐一沉淀分离,将含有A+、B2+、C3+离子的水溶液进行如下实验,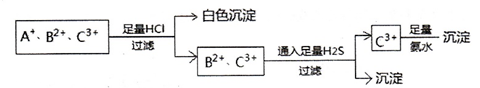
关于三种离子的判断正确的是
| A.Ag+、Fe2+、Al3+ | B.NH4+、Fe2+、Fe3+ | C.Ag+、Cu2+、Fe3+ | D.Ag+、Cu2+、A13+ |
测定硫酸铜晶体(CuSO4·xH2O)中x值的实验过程如下。完成下列填空:
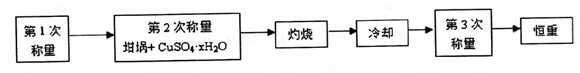
(1)设待测硫酸铜晶体的化学式为CuSO4·xH2O ,则该硫酸铜晶体受热失去全部结晶水的化学方程式为 。
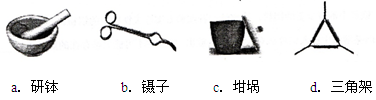
(2)下列是实验中用到的几种仪器,仪器与对应名称正确的是 。(填序号)
(3)“冷却”操作应在 (填仪器名称)中进行,“灼烧”时热源选用的是酒精灯而不是酒精喷灯,理由是 。
(4)恒重操作的目的是 。
(5)测定硫酸铜晶体结晶水含量时,若实验结果偏低,原因可能是 。(填序号)
a.坩埚未完全干燥 b.加热过程中晶体有少量溅失
c.坩埚上沾有受热不分解的杂质 d.加热后未放入干燥器中冷却
(6)下面是某学生实验的一次数据,请完成计算
| 加热前质量 |
加热后质量 |
||
| m1 |
m2 |
m3 |
m4 |
| 11.721g |
22.692g |
18.631g |
a |
①若无需再进行第三次称量,则a的数值范围应为 。
②若加热后坩埚与固体总质量为18.631g,实测值x= (保留两位小数)
③若理论值x=5,则该实验的相对误差是 。
已知下列数据:
| 物 质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
||
| 乙 醇 |
-114 |
78 |
0.789 |
||
| 乙 酸 |
16.6 |
117.9 |
1.05 |
||
| 乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
||
| 浓H2SO4 |
|
338 |
1.84 |
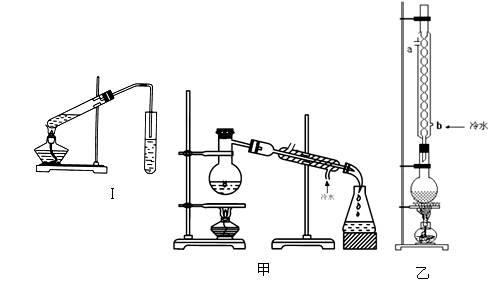
实验室制乙酸乙酯的主要装置如上图I所示,主要步骤为:①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到15mL试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处,③小火加热试管中的混合液;④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;⑤分离出纯净的乙酸乙酯。
请同学们回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是 。
(2)写出该反应的化学方程式 。浓H2SO4的作用是 。
(3)步骤③中,用小火加热试管中的混合液,其原因是: 。
(4)步骤④所观察到的现象 ,写出原因是_______________。
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是________,产物应从_______口倒出,因为______________。
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物)。你认为 装置合理,因为 。
关于某无色溶液中所含离子的鉴别,下列叙述正确的是
| A.加入Ba(NO3)2溶液生成白色沉淀,加入盐酸后沉淀不消失,则原溶液中一定含有SO42- |
| B.通入Cl2后溶液变黄色,加入淀粉溶液后溶液变蓝,则原溶液中一定有I- |
| C.加入盐酸生成的气体能使饱和的澄清石灰水变浑浊,则原溶液中一定含有CO32- |
| D.加入NaOH溶液并加热产生的气体能使湿润蓝色石蕊试纸变红,则原溶液中一定有NH4+ |
为了提纯下列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是
| 选项 |
被提纯的物质 |
除杂试剂 |
分离方法 |
| A |
溴苯(溴) |
水 |
分液 |
| B |
乙酸乙酯(乙酸) |
NaOH溶液 |
分液 |
| C |
苯(苯酚) |
NaOH溶液 |
分液 |
| D |
甲烷(乙烯) |
KMnO4酸性溶液 |
洗气 |
为检验某溶液中的离子,下列操作方法及结论正确的是
| A.加入氯水,再加入KSCN溶液,溶液显红色,则溶液中一定含有Fe2+ |
| B.加入盐酸,产生无色无味且能使澄清石灰水变浑浊的气体,则溶液中一定含有CO32- |
| C.加入Ba(NO3)2溶液,再加入稀盐酸,产生白色沉淀,则溶液中一定含有SO42- |
| D.加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则溶液中一定含有NH4+ |
海水提镁的工业流程如下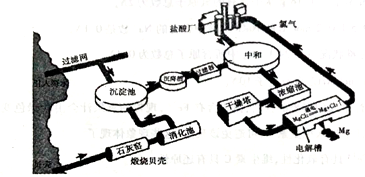
(1)煅烧贝壳时,贝壳的主要成分发生了什么变化?__________(用化学方程式表示)。
(2)从海水中的镁离子到金属镁,主要经历了三步化学变化,写出前两步反应的化学反应方程式:
①______________;②_______________。
③第三步反应(MgCl2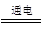 Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
(3)在生产过程中采用了一些措施提高经济效益,请写出一点____________________。
(4)输送氯气的管道需要定期检查是否漏气,管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下):2NH3+3Cl2=N2+6HCl。下列说法中正确的是__________。
A.用该方法检验管道泄漏处会产生白烟
B.管道泄漏处会闻到刺激性气味
C.该反应中的HCl是氧化产物,N2是还原产物