某混合物的水溶液中可能含有以下离子中的若干种:Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-,现分别取100 mL的两份溶液进行如下实验。
①第一份加过量NaOH溶液后加热,收集到0.03 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到23.3g固体,向滤液中加入AgNO3溶液又有白色沉淀产生。下列有关叙述正确的是
| A.由①可知原溶液存在离子为NH4+,其浓度为0.03mol/L |
| B.原溶液肯定没有Fe3+、Mg2+,一定含有Na+ |
| C.n(NH4+):n(Al3+):n(SO42-)=3:1:10 |
| D.原溶液一定存在Cl- |
I.某火力发电厂以煤为燃料,排出的废气中含有CO2、SO2、水蒸气。为检验该废气中的成分,用如图所示的装置进行实验:
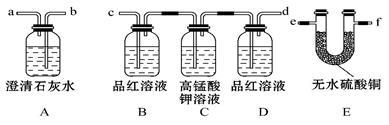
(1)仪器连接的顺序为(填导管接口字母) ;
(2)根据 现象证明有CO2;
(3)装置B的作用是 ,装置D的作用是 。
II. 为探究SO2的漂白是SO2直接作用于有色物质,还是SO2与水反应的产物的作用,设计如图装置进行实验:(图中所用硫酸的质量分数为70%)
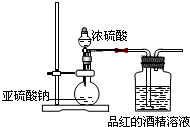
(4)亚硫酸钠与浓硫酸反应的化学方程式: ;
(5)为探究干燥的SO2能不能使品红褪色,请指出设计的实验装置图中两个明显的不足:
① ,
② ;
(6)按照修改后的装置,实验中控制SO2以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色。这说明品红褪色的原因不是SO2直接导致。所以,SO2通过品红水溶液后,引起品红褪色的微粒可能是 。
用一种试剂就能把Na2SO4、鸡蛋白的水溶液、(NH4)2SO4、NH4Cl四种溶液区分开来,这种试剂是:
| A.Ba(OH)2 | B.NaOH | C.BaCl2 | D.AgNO3 |
检验溶液中是否含有某种离子,下列操作方法正确的是:
| A.加入AgNO3溶液,有白色沉淀生成,证明含有Cl- |
| B.加入BaCl2溶液,产生白色沉淀,证明有SO42- |
| C.加浓NaOH溶液后加热,产生使润湿的红色石蕊试纸变蓝色的气体,证明有NH4+ |
| D.加入盐酸,放出能使澄清的石灰水变浑浊的气体,证明有CO32- |
量取100mL碘的饱和水溶液,倒入分液漏斗中,然后再注入4mL四氯化碳,用力振荡后静置,实验现象为:
| A.液体分层,下层为四氯化碳层,紫色 |
| B.液体分层,上层为水层,紫色 |
| C.液体分层,上层为四氯化碳层,黄色 |
| D.液体分层,下层为水层,黄色 |
区别棉花和羊毛的最简单的方法是:
| A.加入稀硫酸后加热使之水解,检验水解产物能否发生银镜反应 |
| B.浸入浓硝酸中,观察其颜色是否变黄色 |
| C.在火中灼烧,闻其是否有烧焦羽毛的气味 |
| D.通过化学方法测其组成中是否含有硫、氮等元素 |
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
①向该待测液中加入过量的稀盐酸,有白色沉淀生成。
②过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
③过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
④另取少量步骤③中的滤液,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
(1)待测液中一定含有 离子,一定不含有 离子。
(2)还有一种离子无法确定是否存在,检验该离子实验方法的名称是 观察到的现象是 。
下列溶液中能用来区别SO2和CO2气体的是( )
①澄清的石灰水 ②氢硫酸 ③氯水 ④酸性高锰酸钾溶液 ⑤氯化钡溶液 ⑥品红溶液
| A.①⑤ | B.③④⑤ | C.②⑥ | D.②③④⑥ |
下列有关离子(或物质)的检验及结论正确的是
| A.用洁净铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰黄色,则溶液中一定不含K+ |
| B.向无色溶液中加入盐酸酸化的BaCl2溶液有白色沉淀出现,则溶液中含有SO42ˉ |
| C.向某溶液中滴加少量氯水,再滴加KSCN溶液,若溶液变成血红色,则原溶液中一定有Fe2+ |
| D.向某黄色溶液中加入淀粉溶液,若溶液变蓝色,则原溶液中含有I2 |
下列除杂试剂(括号内为杂质)选择正确的是( )
| A.CO2(SO2):澄清石灰水 | B.CO2(CO):通入氧气,并加热 |
| C.Cl2(HCl):饱和碳酸钠溶液 | D.Fe(Al):烧碱溶液 |
对于某些离子的检验及结论一定正确的是( )
| A.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42﹣ |
| B.加入氢氧化钠溶液,先产生白色沉淀,后迅速变为灰绿色,最后变为红褐色,一定有Fe2+ |
| C.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32﹣ |
| D.加入硝酸银溶液产生白色沉淀,再加稀硝酸,白色沉淀不溶解,一定有Ag+ |
要证明氯乙烷中氯元素的存在可进行如下操作,其中顺序正确的是( )
①加入AgNO3溶液;②加入NaOH溶液;③加热;④加入蒸馏水;⑤加入HNO3酸化
| A.②③⑤① | B.④③⑤① | C.④①⑤ | D.②③①⑤ |
现有溴苯、乙醇、甲苯 、己烯四种液体,只用一种试剂就可以将它们区别开,这种试剂
是 ( )
| A.溴水 | B.食盐水 | C.NaOH溶液 | D.酸性KMnO4溶液 |
Ⅰ.已知:I2+2S2O=S4O+2I-。相关物质的溶度积常数见下表:
| 物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
| Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入 ,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是 。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,用淀粉溶液作指示剂,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①CuCl2溶液与KI反应的离子方程式为 。
②该试样中CuCl2·2H2O的质量百分数为 。
Ⅱ.乙醇是重要的有机化工原料,可由乙烯直接水合法生产。
已知:乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g) △H=—45.5KJ·mol-1
下图为气相直接水合法乙烯的平衡转化率与温度、压强的关系(其中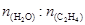 =1:1)
=1:1)
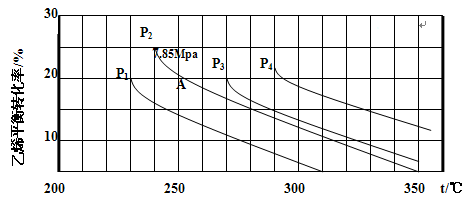
(4)图中压强(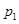 、
、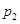 、
、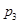 、
、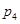 )由大到小顺序为 。
)由大到小顺序为 。
(5)计算乙烯水合制乙醇反应在图中A点(P2=7.85Mpa,乙烯平衡转化率为20%)的平衡常数Kp= (要求写出解题过程)。
本小题提示:用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。