江苏省宿迁市高二上学期期末考试化学试卷
为扼制温室效应,使用下列燃料可实现二氧化碳零排放的是
| A.氢气 | B.天然气 | C.汽油 | D.乙醇汽油 |
中国著名药学家屠呦呦因制成了青蒿素而获得2015年度诺贝尔生理 学或医学奖。青蒿素的结构如右图,关于该物质的分类正确的是
| A.单质 | B.有机物 |
| C.无机物 | D.有机高分子化合物 |
钚( )是制造威力更大原子弹的良好原料。下列有关说法错误的是
)是制造威力更大原子弹的良好原料。下列有关说法错误的是
| A.原子序数为94 | B.质子数为94 | C.质量数为239 | D.中子数为94 |
用一束光通过淀粉溶液时,产生丁达尔现象,说明淀粉溶液属于
| A.溶液 | B.胶体 | C.悬浊液 | D.乳浊液 |
下列各组物质中互为同分异构体的是
| A.CH3CH2OH 和CH3OCH3 | B.CH4和CH3CH3 |
| C.126C与136C | D.金刚石和石墨 |
下列物质的名称、俗名与化学式完全对应的是
| A.氯化钠 食盐 NaCl2 | B.碳酸氢钠 纯碱 NaHCO3 |
| C.氢氧化钠 烧碱 NaOH | D.氢氧化钙 熟石灰 CaO |
在汽车尾气处理装置中加入某种催化剂,发生如下反应:4CO+2NO2===4CO2+N2。下列对该反应的说法中错误的是
| A.该反应中氧化剂是CO、还原剂是NO2 |
| B.该反应是氧化还原反应 |
| C.该反应生成28 g N2时,转移8 mol e- |
| D.该反应能减少汽车尾气对环境的污染 |
下列化学用语书写正确的是
A.氯原子的结构示意图: |
| B.乙烯的结构简式为CH2CH2 |
C.氯化镁的电子式: |
| D.硫酸的电离方程式:H2SO4=== H2+ + SO42ˉ |
对于硫酸工业中SO2的催化氧化反应 2SO2+O2 2SO3,下列说法错误的是
2SO3,下列说法错误的是
| A.使用催化剂能加快化学反应速率 |
| B.增大O2浓度可以使SO2转化率达到100% |
| C.降低反应温度,化学反应速率减慢 |
| D.增大O2浓度,化学反应速率增大 |
下列关于乙酸的说法正确的是
| A.酸性比碳酸弱 | B.可以使紫色石蕊试液变红 |
| C.难溶于水 | D.能被氧化为乙醛 |
某溶液中存在大量的OH—、Na+、SO42—,该溶液中还可能大量存在的离子是
| A.Al3+ | B.Ba2+ | C.NH4+ | D.CO32ˉ |
下列反应过程中的能量变化情况符合右图的是

| A.NaOH与H2SO4发生中和反应 |
| B.氧化钙和水反应 |
| C.NH4Cl和Ba(OH)2.8H2O的反应 |
| D.一氧化碳气体的燃烧 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.54 g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA |
| B.同温同压下,NA个NO2与NA个N2和O2的混合气体的体积不相等 |
| C.1mol·L-1的MgCl2溶液中,含有Cl-个数为2NA |
| D.11.2L氧气中所含有的原子数为NA |
下列反应的离子方程式书写正确的是
| A.硫酸和氯氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| B.碳酸钠与盐酸反应:Na2CO3+2H+=2Na++CO2↑+H2O |
| C.Ca(NO3)2溶液和Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
| D.铁钉放入硫酸铁溶液中:Fe+Fe3+=2Fe2+ |
对于某些离子的检验及结论正确的是
| A.向某溶液中滴加NaOH溶液并加热,用湿润的蓝色石蕊试纸于试管口以检验NH4+ |
| B.加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42- |
| C.某待测液焰色反应呈黄色,则待测液中一定不含有K+ |
| D.某溶液中加入KSCN后,溶液无变化,再加入H2O2后,溶液变成血红色,说明原溶液中一定含有Fe2+ |
某原电池结构如右图所示,下列有关该原电池的说法正确的是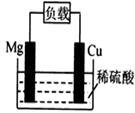
| A.电池反应为:Mg+2H+=Mg2++H2↑ |
| B.镁棒发生还原反应 |
| C.电子从铜棒经外电路流向镁棒 |
| D.铜棒为负极 |
下列有机反应属于加成反应的是
A.CH4+Cl2  CH3Cl+HCl CH3Cl+HCl |
B.CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O |
C.H2C=CH2 + HCl H2C-CH2Cl H2C-CH2Cl |
D.2CH3CH2OH + O2 2CH3CHO + 2H2O 2CH3CHO + 2H2O |
X、Y、Z、R、W是原子序数依次增大的短周期主族元素,X是元素周期表中原子半径最小的元素。X与Z同主族,Y与W同主族,R最外层电子数是电子层数的2倍。下列叙述正确的是
| A.原子半径:W>R>Z |
| B.W的最高价氧化物对应的水化物酸性比R的强 |
| C.W与X形成的是离子化合物 |
| D.W的气态氢化物的热稳定性比Y的强 |
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。某课外活动小组为确定反应后的废液组成,进行如下实验:(1)取100.00mL反应后的废液加入足量的AgNO3溶液,生成沉淀12.915g。(2)另取100.00mL反应后的废液加入过量铜片充分反应,铜片质量减少了0.32g。下列关于反应后的废液组成判断正确的是
| A.只含有Fe 2+、Cu2+、Clˉ,不含有Fe 3+ |
| B.c(Fe2+)︰c(Cu2+) = 1︰1 |
| C.c(Fe3+)︰c(Fe2+)= 1︰3 |
| D.c(Clˉ) ="0.9mol" / L,c(Fe 3+) =" 0.1mol" / L |
本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》
(1)改善环境质量已成为全球共识。保护环境,人人有责。
①空气质量报告的各项指标可以反映出该地区的空气质量状况,下列不需要监测的成分是 (填字母)。
A. SO2 B. N2 C. 可吸入颗粒物
②pH< 的雨水称为酸雨,煤炭燃烧产生的SO2所形成的酸雨,其最终的主要成分是 (填化学式)。
③煤中加入石灰石可以大大减少SO2的排放,发生反应的化学方程式: 。
(2)保持营养均衡,合理使用药物是人类健康的重要保证。
①人体内提供能量的主要营养物质为 、糖类和蛋白质,人体内蛋白质在蛋白酶作用下水解的最终产物是 。
②维生素C能防治坏血病并具有还原性,验证维生素C有还原性可以使用淀粉溶液和 试剂共同完成。
③咽喉发炎的病人可以使用药物 (填“氢氧化铝”或“青霉素”),起到杀菌消炎作用。
④阿司匹林(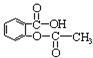 )在人体内可以水解为水杨酸(
)在人体内可以水解为水杨酸( 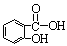 )和一种生活中常见的酸味剂,具有解热镇痛疗效,写出其水解的化学方程式: 。
)和一种生活中常见的酸味剂,具有解热镇痛疗效,写出其水解的化学方程式: 。
(3)(4分)材料是人类生活的物质基础,新型材料的制造则是科技快速发展的重要标志。
①钢铁是制造铁路、桥梁、轮船等的主要材料,钢铁在潮湿的空气中主要发生 腐蚀(填“吸氧”或“析氢”),腐蚀时Fe作为原电池的 极。
②目前,很多地方使用的泡沫塑料快餐具的主要成分是聚苯乙烯(简称EPS),聚苯乙烯属于 (填字母)。
A. 无机非金属材料 B. 金属材料 C. 有机高分子材料
③工业上生产玻璃、水泥都要用到的原料是 。
《有机化学基础》
(1)根据结构对有机物进行分类,有助于对其性质的掌握。
① 有机物苯属于 (填字母)。
a.芳香烃 b.烯烃 c.炔烃
② 下列有机物属于酚类的是 (填字母)。

③ 纤维素属于 (填字母)。
a.糖类 b.油脂 c.蛋白质
(2)柴胡红景天中的活性成分之一是鞣花酸(结构式如右图)。
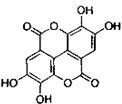
①鞣花酸的分子式为 ;
②鞣花酸分子中含氧官能团为 和 (写名称);
③1mol鞣花酸最多可与 mol Br2发生取代反应;
1mol鞣花酸最多可与含 mol NaOH的溶液发生反应.
(3)莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.

①区别两种酸的方法是 。
莽草酸与溴水的反应方程式: 。
②等物质的量的两种酸与足量NaOH溶液反应,消耗氢氧化钠物质的量之比是 。
③鞣酸的核磁共振氢谱图(H核磁共振谱图)上有 个吸收峰。
下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B与气体C相遇产生白烟,A是强碱,D的焰色反应呈紫色(部分反应物和生成物及溶剂水已略去)。
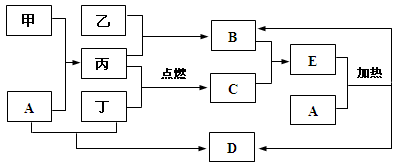
请回答下列问题:
(1)D的化学式为 。
(2)C的电子式为 。
(3)写出A溶液和甲反应的离子方程式: 。
(4)写出工业上制备B的化学方程式: 。
胆矾(CuSO4·5H2O)是铜的重要化合物,有着广泛的应用,如用来配制农药波尔多液。以下是CuSO4·5H2O的实验室制备流程图。
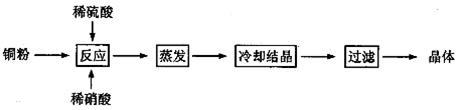
根据题意完成下列填空:
(1)向含有铜粉的稀硫酸中滴加硝酸,在铜粉溶解时最终可以观察到的实验现象: 、 。
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是 (填化学式)。
(3)将CuSO4·5H2O与NaHCO3按一定的比例共同投入到150mL沸水中,剧烈搅拌,冷却后,有绿色晶体析出。该晶体的化学组成为Cux (OH) y (CO3) z·nH2O。实验所得的绿色晶体需充分洗涤,检验是否洗涤干净的方法是 。
(4)为了确定晶体的化学式,某实验小组进行如下实验:a.称取3.640g晶体,加入足量的稀盐酸使固体完全溶解,收集到标准状况下的气体448.0 mL;b.称取等质量的晶体,灼烧至完全分解,得到2.400g残余固体。通过计算确定晶体的化学式(写出计算过程)。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号