陕西省宝鸡市岐山县高一上学期期末质检化学试卷
下列物质的存贮方法错误的是
| A.金属钠保存在石蜡油或煤油中 |
| B.用铁制或铝制容器运输浓硫酸、浓硝酸 |
| C.FeCl2溶液的试剂瓶中要放铁钉 |
| D.氢氧化钠溶液盛装在玻璃塞的试剂瓶中 |
下面关于Fe(OH)3胶体叙述中不正确的是
| A.用光照有丁达尔现象 | B.能透过滤纸 |
| C.加入过量盐酸,最后发生聚沉 | D.能发生电泳现象 |
某无色酸性溶液中能大量共存的离子组是
| A.K+、Mg2+、Cl-、NO3- | B.Ba2+、SO42-、Cl-、OH- |
| C.K+、OH-、CO32-、MnO4- | D.Ca2+、K+、Cl-、HCO3- |
下列有关叙述正确的是
| A.溶液因不带电而稳定,胶体因带电而不稳定 |
| B.做焰色反应实验前,铂丝应先用盐酸洗涤后灼烧至无色 |
| C.氯水与亚硫酸钠溶液的混合液,漂白性更强 |
| D.不慎将浓硫酸沾到皮肤上,立即用大量水冲洗,然后涂上烧碱溶液 |
下列推断合理的是
| A.Cu的活动性排在H之后,不能与浓H2SO4发生反应 |
| B.金刚石是自然界中硬度最大的物质,不能与氧气发生反应 |
| C.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒、②10 mL量筒、③50 mL烧杯、④托盘天平、⑤100 mL容量瓶、⑥胶头滴管、⑦玻璃棒,按使用仪器的先后顺序排列正确的是
| A.④③⑦⑤⑥ | B.②⑤⑦⑥ | C.①③⑤⑥⑦ | D.②⑥③⑦⑤⑥ |
下列反应中,离子方程式为H++OH-===H2O的是
| A.CH3COOH+NaOH===CH3COONa+H2O |
| B.HNO3+KOH===KNO3+H2O |
| C.H2SO4+Ba(OH)2===BaSO4↓+2H2O |
| D.2HCl+Cu(OH)2===CuCl2+2H2O |
下列有关离子的检验方法和判断正确的是
| A.向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+ |
| B.向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+ |
| C.向某溶液中滴加足量稀HCl,产生气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- |
| D.用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色,说明原溶液中不含K+ |
以下物质间的每步转化都是通过一步反应能实现的是
| A.Al→Al2O3→Al(OH)3→NaAlO2 | B.Fe→FeO→Fe(OH)2→Fe(OH)3 |
| C.S→SO3→H2SO4→MgSO4 | D.N2→NO→NO2→HNO3 |
能选用右图装置正确完成的实验是
| A.用铅粒与稀硫酸制取并收集H2 |
| B.用少量MnO2和H2O2制取并收集O2 |
| C.用生石灰和浓氨水制取并收集NH3 |
| D.用浓硫酸和浓盐酸制取并收集HCl |
对反应2Al+2NaOH+2H2O="=" 2NaAlO2+3H2↑的说法正确的是
| A.氧化剂是NaOH | B.生成3mol H2时转移了6mol电子 |
| C.反应中的Al被还原 | D.1molAl失电子,有2molH2O中的氢得电子 |
设NA表示阿伏加德罗常数,下列说法正确的是
| A.标准状况下,22.4LCO2与CO的混合气体含NA个分子 |
| B.标准状况下,22.4LSO3含有NA个分子 |
| C.1molNa2O2与足量CO2反应转移的电子数为2NA |
| D.常温下NA个H2分子的质量约为2g,它所占的体积约为22.4L |
下列反应的离子方程式正确的是
| A.澄清的石灰水跟盐酸反应:2H++Ca(OH)2="=" Ca2++2H2O |
| B.铁和稀硫酸反应:2Fe + 6H+ =2Fe 3+ +3H 2↑ |
| C.NaHCO3溶液与NaOH溶液反应: OH-+ HCO3-=CO32-+ H2O |
| D.金属钠跟水反应: Na+2H2O ==Na++2OH-+H2↑ |
2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法正确的是 
| A.NO2是该过程的最终产物 |
| B.NO和O2必须在催化剂表面才能反应 |
| C.汽车尾气的主要污染成分是CO2和NO |
D.该催化转化的总反应方程式为:2NO +O2 +4CO 4CO2+N2 4CO2+N2 |
等质量的镁和铝分别与足量的稀盐酸反应后,在相同状况下生成的气体的体积比是
| A.1∶1 | B.3∶4 | C.2∶3 | D.4∶3 |
(1)地壳中含量最高的金属是 ,NaHCO3俗称 ,制造计算机芯片的半导体材料是 ,水晶项链的主要成分是 。
(2)在反应3Cu+8 HNO3(稀)="=" 3Cu(NO3)2+2NO↑+4H2O中,失去电子的是_________(填元素符号),被还原的是_______(填元素符号)。当产生标况下4.48 L气体时消耗单质铜 g,此时转移了_______ mol电子。
(1)过氧化钠可用于呼吸面具或潜艇中的氧气来源,则人呼出的气体与过氧化钠反应的化学方程式为: 、 。
(2)新生成的氢氧化亚铁在空气中会迅速变灰绿色、最后变为红褐色,其化学方程式为: 。
(3)铝制餐具长时间存放酸性、碱性或咸的食物,就会受到腐蚀。其中碱性食物与铝制品的氧化膜发生反应的离子方程式为 。
小王同学在一次实验中发现:把新制氯水逐滴加到含有酚酞的氢氧化钠溶液中,当加到最后一滴时溶液的红色突然消失。
(1)知识储备:将氯气通入水中的化学方程式为 ;氯水中具有强氧化性的分子有 、 。
(2)探究“溶液的红色突然消失”的原因:
①猜想:a.是氯水中的盐酸中和了NaOH,使酚酞由红色变成无色;
b.是 。
②设计实验:往已褪色的溶液中连续滴加NaOH溶液至过量,若现象为 ,则证明“猜想a”正确;若现象为 ,则“猜想b”正确。
为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器 (内含物质)组装成实验装置[已知:酸性H2SO3>H2CO3,Ca(HSO3)2溶于水]:
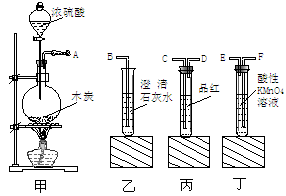
(1)甲中反应的化学方程式为: 。
(2)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母): 接 , 接 , 接 。
(3)要检验出CO2,实验现象是:乙中 ,丙中 。
(4)丁中酸性KMnO4溶液的作用是 ;丙中品红的作用是 。
硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。下图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:
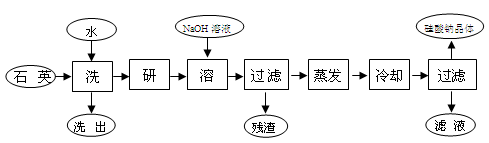
(1)要将洗出液中的溶质析出,采用的方法是 (填:“蒸发”、“降温”)结晶;蒸发时用到的硅酸盐仪器有 、 、 。
(2)上述流程中加入NaOH溶液,反应的离子方程式为 。
(3)用上述残渣中的氧化铁焊接铁轨,其铝热反应的化学方程式为(并在方程式中用“单线桥”标出电子转移方向和数目) 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号