下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是
| A.产生气体体积 ①=② |
| B.①中阴极质量增加,②中正极质量减小 |
| C.溶液的pH变化:①减小,②增大 |
| D.电极反应式①中阳极:4OH- - 4e- =2H2O+O2↑, |
②中负极:2H++2e-=H2↑
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍。电解时,下列有关叙述正确的是(已知氧化性Fe2+<Ni2+<Cu2+)
| A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— = Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是

已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:
Ni2+(高浓度)>H+>Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
| A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+ |
| B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
化学与人类生产、生活密切相关,下列有关说法正确的是
| A.工业上用惰性电极电解熔融的MgO可制得Mg |
| B.氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂 |
| C.草木灰可与铵态氮肥混合施用 |
| D.为加快漂白精的漂白速率,使用时可滴加几滴醋酸 |
用惰性电极电解CuSO4和NaCl的混合溶液,开始时阴极和阳极上析出的物质分别是( )
| A.H2和Cl2 | B.Cu和Cl2 | C.H2和O2 | D.Cu和O2 |
在化学能与电能的转化过程中,下列叙述正确的是 ( )
| A.电解饱和食盐水时,阳极得到Cl2 和NaOH(aq) |
| B.教材所示的铜-锌原电池在工作时,Zn2+ 向铜片附近迁移 |
| C.电镀时,电镀槽里的负极材料发生氧化反应 |
| D.原电池与电解池连接后,电子从原电池负极流向电解池阳极 |
如图所示装配仪器,接通直流电源,电解饱和食盐水,则电解一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是 ( )

| A.H2 | B.O2 | C.Cl2 | D.HCl |
中国人民银行定于2011年4月15日发行中国京剧脸谱彩色金银纪念币,其中银纪念币材料为铜芯镀银,依据你所掌握的电镀原理,你认为银纪念币制作时,铜芯应做
| A.阴极 | B.阳极 | C.正极 | D.负极 |
用惰性电极电解下列溶液,一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是
| A.CuCl2 (CuO) | B.NaOH (NaOH) |
| C.CuSO4 (CuCO3) | D.NaCl (NaOH) |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
| A.放电时锌作负极 |
| B.充电时氢氧化铁被氧化 |
| C.放电时溶液的碱性增强 |
| D.放电时转移3 mol e-,有2 mol FeO42-被还原 |
如图是模拟电化学反应装置图。下列说法正确的是( )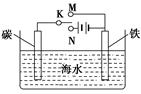
| A.开关K置于N处,则铁电极的电极反应式为:Fe-2e-=Fe2+ |
| B.开关K置于N处,可以减缓铁的腐蚀 |
| C.开关K置于M处,则铁电极的电极反应式为:2Cl--2e-=Cl2↑ |
| D.开关K置于M处,电子从碳棒经开关K流向铁棒 |
下列描述不符合生产、生活实际的是
| A.家用炒锅残留盐溶液时易发生吸氧腐蚀 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解水制氢气时,用铜作阳极 |
| D.在镀件上电镀锌,用锌作阳极 |