将 0.1 L 含有 0.02mol CuSO4和 0.01molNaCl 的水溶液用惰性电极电解。电解一段时间后,一个电极上得到 0.01 mol Cu,另一电极析出的气体( )
| A.只有Cl2 | B.既有Cl2又有O2 | C.只有O2 | D.只有H2 |
下列说法正确的是:
| A.工业上常使用电解精炼法将粗铜提纯,在电解精练时,阳极减少的质量等于阴极增加的质量 |
| B.心脏起搏器中使用的新型Li-I2电池的寿命已超过10年,其反应可简单表示为2Li+I2=2LiI,阴极反应为:2Li-2e-=2Li+ |
| C.为了降低某水库的铁闸门被腐蚀的速率,其中焊接在铁闸门上的金属材料可以是锌 |
| D.某物质的溶解度为难溶,则该物质不溶于水 |
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如右图所示,下列说法中不正确的是
| A.A为电源正极 |
| B.阴极区附近溶液pH降低 |
| C.阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O |
| D.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O72-被还原 |
下列有关电化学装置的说法正确的是
| A.利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2- |
| B.图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出 |
| C.图c中的X极若为负极,则该装置可实现粗铜的精炼 |
| D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
下列说法不正确的是
| A.原电池外电路中电子由负极流向正极 |
| B.原电池中发生还原反应的电极是正极 |
| C.电解池中发生还原反应的电极是阳极 |
| D.电解池中质量增加的电极是阴极 |
某化学兴趣小组进行化学实验,按照左图连接好线路发现灯泡不亮,按照右图连接好线路发现灯泡亮,由此得出的结论不正确的是: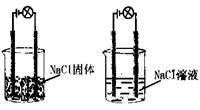
| A.NaCl是电解质 |
| B.NaCl溶液是电解质 |
| C.NaCl在水溶液中电离出可以自由移动的离子 |
| D.NaCl溶液可以导电 |
已知某电解质溶液pH=a,向其中插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )
| A.Na2SO4 | B.H2SO4 | C.AgNO3 | D.NaOH |
下列叙述中,正确的是 ( )
①锌跟稀硫酸反应制取氢气,加入少量CuSO4溶液能提高反应速率 ②镀层破损后,白铁(镀锌的铁)比马口铁(铁锡的铁)更易腐蚀 ③电镀时应把镀件置于电解槽的阴极 ④冶炼铝时,把氧化铝加热成为熔融体后电解 ⑤钢铁表面常易腐蚀生成Fe2O3·nH2O
| A.①②③④⑤ | B.①③④⑤ | C.①③⑤ | D.②④ |
用铅蓄电池电解苦卤水 (含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中正确的是
| A.铅蓄电池负极的反应式为:Pb-2e -→ Pb2+ |
| B.铅蓄电池放电时,该电池两极质量均减少 |
| C.铅蓄电池充电时,B极应与外电源负极相连 |
| D.电解苦卤水时,a电极首先放电的是Br- |
LiOH是制备锂离子电池的材料,可由电解法制备。工业上利用如图装置电解制备 LiOH,两电极区电解液分别为LiOH和LiCl溶液,下列叙述正确的是
| A.B极区电解液为LiOH溶液 |
| B.电极每产生22.4L气体,电路中转移2mole- |
| C.电解过程中Li+迁移入B电极区、OH-迁移入A电极区 |
D.电解池中总反应方程式为:2HCl 2H2↑+Cl2↑ 2H2↑+Cl2↑ |
用石墨电极分别电解下列足量物质的水溶液一段时间后,向剩余电解质溶液中加入一定量的一种物质(括号内),溶液能恢复到与原来溶液完全一样的是
| A.CuCl2(HCl) | B.NaOH(NaOH) | C.NaCl(HCl) | D.CuSO4[Cu(OH)2] |