随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) 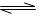 CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.
CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.
测得CO2和CH3OH(g)的浓度随时间变化如图所示。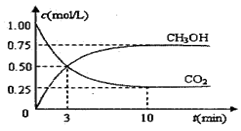
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
(2)该反应的平衡常数为 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入lmol CO2和3mol H2
(4)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H= —1275.6kJ/mol
②H2O(g)=H2O(1) △H= —44.0kJ/mol
则甲醇的燃烧热化学方程式为: ;
(5)如果燃烧甲醇会造成大量化学能损失,如果以甲醇和空气为原料,以氢氧化钠为电解质溶液设计成原电池将有很多优点,请书写出该电池的负极反应:___________________
(6)常温下,某水溶液M中存在的离子有:Na+、A—、H+、OH—。若该溶液M由 pH=3的HA溶液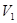 mL与pH=11的NaOH溶液
mL与pH=11的NaOH溶液 mL混合反应而得,则下列说法中正确的是 __。
mL混合反应而得,则下列说法中正确的是 __。
A.若溶液M呈中性,则溶液M中c(H+)+c(OH—)=2×10—7mol·L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
在一容积为2 L的密闭容器内加入0.2 molA和0.6 molB,在一定条件下发生反应:A(s)+3B(g) 2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
64.0 |
50.7 |
42.9 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ,ΔH 0(填“>”或“<”)。
(2)1000 ℃时,4 min后达到平衡.求4 min内D的平均反应速率v(D)= ,B的平衡转化率为 ,平衡时B的体积分数 。
(3)欲提高⑵中B的平衡转化率,可采取的措施是
A.减少C的量 B.增加A的量 C.移出部分D
D.降低反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)1000 ℃时, 在一容积为2 L的密闭容器内加入XmolC和0.6 molD,5 min后达到平衡,B的浓度与⑵中B的浓度相同,求X的范围
(5)下列说法中能说明反应已达到平衡状态的是
A.容器内混合气体的压强不随时间变化而变 B.B的速率不随时间的变化而变化
C.c(B)︰c(D)=1︰1 D.混合气体的密度保持不变(M(B)≠M(D))
(14分,除标明外,每空2分)在实验室进行工业合成氨的模拟实验:
N2(g) + 3H2(g) 2NH3(g) △H<0。当反应达到平衡后,分离出氨,并按与起始时原料气相同的物质的量之比补充N2、H2,以实现连续生产,各组分物质的量和时间的关系如图所示(容器体积为1 L,各平衡状态时N2物质的量均可视为0.9mol)。
2NH3(g) △H<0。当反应达到平衡后,分离出氨,并按与起始时原料气相同的物质的量之比补充N2、H2,以实现连续生产,各组分物质的量和时间的关系如图所示(容器体积为1 L,各平衡状态时N2物质的量均可视为0.9mol)。
(1)①以NH3的浓度变化表示反应开始至15 min时该反应的平均速率是 (保留三位有效数字)。
②I阶段15 min达到平衡,则I阶段的平衡常数为 ;Ⅱ阶段,达到平衡状态时,代表氢气的曲线上的点的坐标为( )。
③H2在I、Ⅱ的平衡转化率aI(H2)、aⅡ(H2)中较小的是 ,其值是 (保留三位有效数字)。
(2)在甲、乙两容器中分别进行反应N2(g) + 3H2 2NH3(g),甲容器容积固定,乙容器容积可变。一定温度下,在甲中充入amol N2、b mol H2(3a>b=3),达到平衡时NH3的物质的量为cmol。
2NH3(g),甲容器容积固定,乙容器容积可变。一定温度下,在甲中充入amol N2、b mol H2(3a>b=3),达到平衡时NH3的物质的量为cmol。
①相同温度下,在乙中加入2a mol N2、2b mol H2,若乙的压强始终与甲的压强相等,乙中反应达到平衡时NH3的物质的量为 mol(填字母序号,下同);若乙的容积与甲的容积始终相等,乙中反应达到平衡时NH3的物质的量为 mol。
| A.大于2c | B.等于2c | C.在c~2c之间 | D.等于c E.小于c |
②相同温度下,保持乙的容积为甲的一半,并加入1mo1NH3,要使乙中反皮达到平衡时,各物质的体积分数与上述甲容器中达到平衡时的相同,则起始时还应加入 和 (用含a、b的代数式表示)。
I.在容积为2.0L,的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如下图,据图同答下列问题:
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为____________________。
(2)根据上图写出该反应的化学方程式_______________________________________,该反应的平衡常数K=_________________。
(3)第5 min时,升高温度,A、B、D的物质的量变化如上图,则降温,该反应的平衡常数_______(填“增大”、“减小”或“不变”)。
Ⅱ.可逆反应:①X(g)+2Y(g) 2Z(g)、②2M(g)
2Z(g)、②2M(g) N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
请同答下列问题:
(1)达平衡(I)时,X的转化率为___________________。
(2) X(g)+2Y(g) 2Z(g)是_________(填“吸”或“放”)热反应。
2Z(g)是_________(填“吸”或“放”)热反应。
(8分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1) 工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO (g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250 ℃ |
300 ℃ |
350 ℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)下列各项能作为判断反应Ⅰ在2 L的密闭容器中达到化学平衡状态的依据的是_______(填序号字母)。
A.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
B.2v(H2)(正)= v(CO)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
用图中所示实验装置证明氧化铜能加快约7%的双氧水的分解并与二氧化锰的催化效果进行比较(即比较反应速率)。用图示装置测量产生气体的体积,其他可能影响实验的因素均已忽略,相关数据如下:
(1)从实验原理来看,实验中的“待测数据”可以指、也可以指 。
(2)实验时气体收集在B中,B仪器名称是__________。若要检验产生的气体是O2,待气体收集结束 后,用弹簧夹夹住B下端乳胶管,打开单孔橡皮塞, 。
(3)为探究CuO在实验②中是否起催化作用,除与①比较外,还需补做下列实验不必写具体步骤):a.证明CuO的化学性质没有变化,b. 。
(4)为证明氧化铜的化学性质在加入双氧水前后没有发生改变,你设计验证的实验是 。
(5)实验开始时,当往容器中加入一定量的双氧水后,由于短时间内产生大量气体,分液漏斗内的液体不能顺利流下,为了解决这个问题,你采取的措施是 ;在测量生成的气体体积时,除了要注意视线与凹液面相平以外,还应注意
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0。已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0。已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1100 ℃时测得高炉中,c(CO2)="0.025" mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应向 进行(填“左”或“右”),判断依据是 。
(2)目前工业上也可用CO2生产燃料甲醇,有关反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
①该反应的化学平衡常数表达式为 ;
②反应达到平衡时,氢气的转化率 α(H2)= ;
③反应达到平衡后,下列措施能使 增大的是 (填序号)。
增大的是 (填序号)。
A 升高温度 B 再充入H2 C 再充入CO2
D 将H2O(g)从体系中分离 E.充入He(g)
I:已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:T℃时物质的浓度(mol•L-1)变化
| 时间/ min |
CO |
H2O(g) |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
0.100 |
0.200 |
0.100 |
0.100 |
| 4 |
0.100 |
0.200 |
0.100 |
0.100 |
| 5 |
0.116 |
0.216 |
0.084 |
C1 |
| 6 |
0.096 |
0.266 |
0.104 |
C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 ,T℃时该化学反应的平衡常数是 。在该温度下,若向一容积固定的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和2.0mol H2,则反应向 进行。(填“正反应方向”或“逆反应方向”)。
(2)已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol•L-1,则CO在此条件下的转化率为 ,如果保持体积不变向该密闭容器中再充入1 mol氩气,平衡时CO的转化率 (填“变大”“不变”“变小”)。
(3)397℃时该反应的平衡常数为12,请判断该反应的△H 0(填“<”、“>”或“=”)。
Ⅱ:工业上可用CO和H2在一定条件下合成甲醇,反应为:
CO(g)+2H2(g) CH3OH(g)ΔH=Q kJ•mol-1
CH3OH(g)ΔH=Q kJ•mol-1
现在容积均为2L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
(1)该反应的Q 0(选填“<”、“>”或“=”,下同),K1 K2。
(2)300℃时,该反应的平衡常数为 。
(3)将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有:____________
(至少答2种) 。
(17分)某反应A(g)+B(g) C(g)在任一时刻的正、逆反应速率可用υ正、υ逆表示:
C(g)在任一时刻的正、逆反应速率可用υ正、υ逆表示:

υ正=k1·c(A)·c(B),υ逆=k2·c(C),其中k1、k2在一定温度下为常数,c(A)、c(B)、c(C)分别代表某时刻三种物质的物质的量浓度。
(1)上述反应达到平衡时,请用题干中的符号分别表示三种物质的浓度关系为 ,
平衡常数K=_ __。
(2)在300 K时,开始反应的A、B浓度均为0.1 mol/L,达到平衡时B的转化率为50%,则k1、k2之间的关系是__________________。
(3)升高温度,k1的变化是 ,k2的变化是_________(填“增大”、“减小”或“不变”);此时若k1/k2增大,则说明正反应是___________(填“吸”或“放”)热反应。
(4) CO2可与H2合成绿色燃料甲醇。300oC时,在两个容积均为2L的密闭容器中,当c(CO2)=1.00 mol·L-1、c(H2)=1.60 mol·L-1时,分别选择催化剂Ⅰ、催化剂Ⅱ开始反应,t0时达到平衡状态M1、M2。若υ逆(M1)<υ正(M2)。且达M1时,CO2的转化率为20%,请画出两个状态的浓度商(Qc)-时间(t)的关系图像,并标明相关数据。
=
(5)实验室可利用甲醇、空气、铜(或氧化铜)制备甲醛。关于甲醇和甲醛的沸点和水溶性见下表:
| |
沸点 |
水溶性 |
| 甲醇 |
65℃ |
与水相溶 |
| 甲醛 |
-21℃ |
与水相溶 |
下图是某同学设计的实验装置,已知A处放入甲醇,C处收集到甲醛,若D处的气球在反应临近结束时使用,则B处应放入______(填化学式),请回答A、B、C三处采取控温的方式分别为A_____、B 、C ,(从下列选项中选择)
a.热水浴加热 b.冰水浴冷却 c.酒精灯加热 d.酒精喷灯灼烧 e.常温即可
实验临近结束时,挤压D处气球使空气进入装置,该操作的目的是____________________。
在密闭容器中进行反应①Fe(s)+C02(g)  FeO(s)+CO(g) ΔH1=akJ·mol一
FeO(s)+CO(g) ΔH1=akJ·mol一
反应②2CO(g)+02(g)  2C02(g) △H2="b" kJ·mol-
2C02(g) △H2="b" kJ·mol-
反应③2Fe(s)+02(g)  2FeO(s)△H3
2FeO(s)△H3
(1) △H3= (用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K= ,已知500℃时反应①的平衡常数K=1.0,在此温度下2 L密闭容器中进行反应①,Fe和C02的起始量均为2.0 mol,达到平衡时CO2的转化率为 ,CO的平衡浓度为 。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是C02浓度的两倍,则a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.再通入CO2 c.升高温度 D.使用合适的催化剂
(4)下列图像符合反应①的是 (填序号)(图中V是速率、φ为混合物中CO含量,T为温度)。
(本题15分)
I.已知:反应
4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH =" —115.6" kJ/mol
2Cl2(g)+2H2O(g) ΔH =" —115.6" kJ/mol
H2(g) + Cl2(g) = 2HCl(g) ΔH =" —184" kJ/mol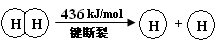

(1)H2与O2反应生成气态水的热化学方程式是 。
(2)断开1 mol H—O 键所需能量约为 kJ。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: ,它所对应的化学方程式为: .
,它所对应的化学方程式为: .
(2)已知在400℃时,N2 (g)+ 3H2(g)  2NH3(g) △H<0 的K="0.5," 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
2NH3(g) △H<0 的K="0.5," 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:
A(g) + 3B(g) 2C(g) + D(s) ΔH,其化学平衡常数K与温度T的关系如下表:
2C(g) + D(s) ΔH,其化学平衡常数K与温度T的关系如下表:
| T/K |
300 |
400 |
500 |
… |
| K/(mol·L-1)2 |
4×106 |
8×107 |
K1 |
… |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)。
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。 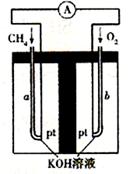
①放电时,负极的电极反应式为 。
②假设装置中盛装100.0 mL 3.0 mol·L-1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系
为 。
(9分) 某化学反应2A(g)  B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度均为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度均为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况如下表:
| 时间 实验序号 |
1 |
10 |
20 |
30 |
40 |
50 |
60 |
|
| 1 |
800 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800 ℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800 ℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820 ℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)实验1中,在10~20 min时间内,以A的速率表示的平均反应速率为
mol•L-1•min-1。
(2)实验2中,A的初始浓度c2= mol•L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3 v1(填“>”“=”或“<”),且c3 = mol•L-1
(4)比较实验4和实验1,可推测该反应的正反应是 反应(填“吸热”或“放热”),理由是 。
(10分)接触法制硫酸工艺中,其主反应在450 ℃并有催化剂存在下进行:
2SO2 (g)+O2 (g)  2SO3(g) H<0。回答下列问题:
2SO3(g) H<0。回答下列问题:
(1)该反应450 ℃时平衡常数_____________500 ℃时平衡常数(填“大于”、“小于”或“等于”)
(2)下列描述中,能说明该反应已达到平衡的是_________________________
| A.v正(O2) = 2v逆(SO3) |
| B.容器中气体的平均相对分子质量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 |
| D.容器中气体的分子总数不随时间而变化 |
(3)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2) = __________________mol/(L·min),若继续通入0.20 mol SO2和0.10 mol O2,则平衡_____________________移动(填“向正反应方向”、“向逆反应反应”或“不”),再次达到平衡后,__________mol<n(SO3)<__________mol
2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为: 2NO(g) + 2CO(g) 2CO2(g) +N2(g) 。在密闭容器中发生该反
2CO2(g) +N2(g) 。在密闭容器中发生该反
应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
①该反应的△H 0(填“>”、“<”)。
②在T2温度下,0~2s内的平均
反应速率v(N2)=" ______________" 。
③当固体催化剂的质量一定时,增大其表面积可提高
化学反应速率。若催化剂的表面积S1>S2,在上图中画出
c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到t1时刻达到平 衡状态的是 ____ (填代号) 
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
例如:
写出CH4 (g)催化还原N2O4(g)生成N2 (g)和H2O (g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目 的。右图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式
为 。
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ |
用炭粉在高温条件下还原CuO |
| 方法Ⅱ |
电解法:2Cu+H2O电解Cu2O+H2↑ |
| 方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)方法Ⅰ制备过程会产生有毒气体,每生成1 g该有毒气体,能量变化a kJ,写出制备反应的热化学方程式 。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米
级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)方法Ⅲ可以用甲醛稀溶液替代肼,但因反应温度较高而使部分产品颗粒过大, (填操作名称)可分离出颗粒过大的Cu2O。
(6)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:
2H2O(g) 2H2(g)+O2(g) ⊿H>0
2H2(g)+O2(g) ⊿H>0
水蒸气的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(O2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。