某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得: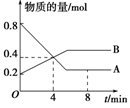
(1)该反应的化学方程式为_________________________________________。
(2)反应开始至4 min时,A的平均反应速率为________________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
在压强为0.1 MPa、10L恒容的密闭容器中,将2 mol CO与 5 mol H2的混合气体在催化剂作用下能生成甲醇:CO(g) + 2H2(g) CH3OH(g) ΔH<0请回答下列问题:
CH3OH(g) ΔH<0请回答下列问题:
(1)①该反应的熵变ΔS 0(填“>”、“<”或“=”)。
②若温度T1 >T2,则平衡常数K(T1) K(T2)(填“大于”、“小于”或“等于”)
③下列措施既可加快反应速率又可增加甲醇产率的是 ;
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入2 mol CO和5 mol H2
④下列可说明反应已达到化学平衡状态的是________;
A.v生成(CH3OH)=v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.CO与H2浓度比不再变化
(2)若温度T2时,5min后反应达到平衡,CO的转化率为75%,则:
①平衡时体系总的物质的量为 mol;
②反应的平衡常数K= ;
③反应在0-5min区间的平均反应速率v(H2)= 。
(15分)甲醇是重要的化工原料,在化工生产中有广泛的应用。
(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢反应生成H2和甲酸甲酯(HCOOCH3)、再分解生成CO和CH3OH。写出相应反应的化学方程式: 。
(2)利用太阳能或生物质能分解水制H2,然后可将H2与C02转化为甲醇。已知:
光催化制氢:2H20(1)=2H2(g)+O2(g)  H=+571.5 kJ·mol-1
H=+571.5 kJ·mol-1
H2与C02耦合反应:3H2(g)十CO2(g)=CH3OH(1)+H20(1)  H= 一137.8 kJ·mol-1
H= 一137.8 kJ·mol-1
则反应:2H2O(1)+C02(g)=CH30H(l)+3/202(g)的 H= kJ·mol-1
H= kJ·mol-1
(3)已知反应:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)  H=Q
H=Q
在20 L的密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的转化率随温度及压强的变化如下图所示,P2及195 ℃时n(H2)随时间的变化如表所示。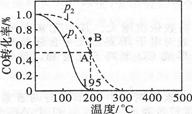

①O~3 min,平均速率V(CH3OH)= ,Q 0(填“<”“=”或“>”)。
②图中压强(P1、P2)的大小顺序为 ,理由是 。
③在P2及195 ℃时,该反应的平衡常数K= 。
Ⅰ.已知:
4Na(g)+3CO2(g)=2Na2CO3(l)+C(s,金刚石) △H=-1080.9kJ/mol
4Na(g)+CO2(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol
试写出固体Na2O与固体C(金刚石)反应得到气体Na和液态Na2CO3的热化学方程式 。
Ⅱ.硝基苯甲酸乙酯在OH— 存在下发生水解反应:O2NC6H4COOC2H5+OH-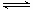 O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示:
| t/s |
0 |
120 |
180 |
240 |
330 |
530 |
600 |
700 |
800 |
| α/% |
0 |
33 |
42 |
49 |
59 |
73 |
74 |
75 |
75 |
回答下列问题:
(1)该反应在330~530s的平均反应速率为 (只列出算式,不做运算)。
(2)试计算某温度下该反应的平衡常数(写出计算过程)。
(3)为提高O2NC6H4COOC2H5的转化率,可以采取的措施有 ,(写2条)。
Ⅲ.(1)下图装置中,开始电解时,Al电极反应式为 ,石墨电极反应式为 。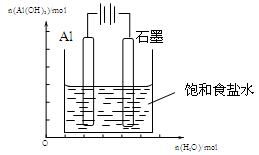
(2)通电一段时间后测得有0.6mol电子转移,作出Al(OH)3物质的量与消耗H2O的物质的量的的图象(反应物足量,作出标注)。
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH="+206.0" kJ·mol―1
CO(g)+3H2(g) ΔH="+206.0" kJ·mol―1
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。
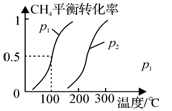
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2)= 。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应:CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。
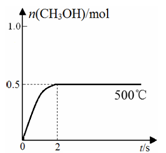
①反应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,
原因是 (用化学方程式表示)。
③在500℃恒压条件下,请在上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g) ΔH="―29.1" kJ·mol―1,科研人员对该反应进行了研究,部分研究结果如下:
HCOOCH3(g) ΔH="―29.1" kJ·mol―1,科研人员对该反应进行了研究,部分研究结果如下:
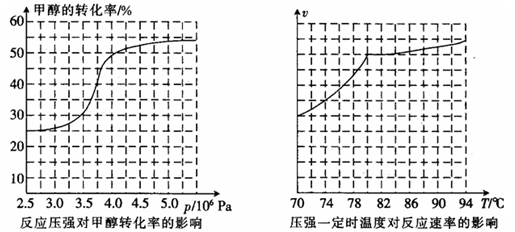
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
运用化学反应原理研究碳的化合物具有重要意义。
(1)常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s) 5CO2(g)+I2(s) △H<0。向2L密闭容器中加入足量I2O5(s),并通人1molCO,CO2的体积分数
5CO2(g)+I2(s) △H<0。向2L密闭容器中加入足量I2O5(s),并通人1molCO,CO2的体积分数 随时间的变化如下图所示:
随时间的变化如下图所示:
①0~0.5min内的平均反应速率v(CO)= _____________。
②保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是______。
a.生成I2的质量为原来的2倍
b.混合气体的平均摩尔质量不变
c.达到平衡的时间为原来的2倍
d.混合气体的密度不变
③反应达a点时,欲增大容器中CO2的体积分数 ,可采取的措施为____________。
,可采取的措施为____________。
(2)以 为催化剂,可以将
为催化剂,可以将 的混合气体直接转化为乙酸。
的混合气体直接转化为乙酸。
①若该反应的原子利用率为100%,则 ______________。
______________。
②在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则: _____14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
_____14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
(3)利用反应 可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
若要求得CO(g)+2H2(g)=CH3OH(l)的△H,还需要知道反应(用化学方程式表示) 的焓变。
(2)工业上合成甲醇一般采用下列反应:CO(g)+2H2(g) CH3OH(g) △H="—a" kJ/mol(a>0),H2的平衡转化率与温度、压强的关系如下图所示。
CH3OH(g) △H="—a" kJ/mol(a>0),H2的平衡转化率与温度、压强的关系如下图所示。
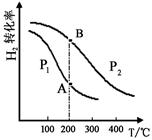
压强:P1 P2(填“>”、“=”或“<”)。
(3)在容积固定的密闭容器中发生CO(g)+2H2(g) CH3OH(g) △H="—a" kJ/mol(a>0),各物质的浓度如下表:
CH3OH(g) △H="—a" kJ/mol(a>0),各物质的浓度如下表:
| 浓度mol/L 时间/min |
c(CO) |
c(H2) |
c(CH3OH) |
| 0 |
0.8 |
1.6 |
0 |
| 2 |
0.6 |
1.2 |
0.2 |
| 4 |
0.3 |
0.6 |
0.5 |
| 6 |
0.3 |
0.6 |
0.5 |
①反应从2 min到4 min之间,H2的反应速率为 。
②反应达到平衡时CO的转化率为 。
③反应在第2 min时改变了反应条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除去(Co3+的还原产物是CO2+)。

①写出阳极电极反应式_____________________________________________________________;
②写出除去甲醇的离子方程式_______________________________________________________。
目前“低碳经济”正成为科学家研究的主要课题。请回答下列问题:
I.甲烷自热重整是一种先进的制氢方法,其反应方程式为:
CH4(g) + H2O(g) CO(g) + 3H2(g)
CO(g) + 3H2(g)
(1)阅读下图,计算该反应的反应热ΔH = __________kJ/mol。
II.用CH4或其他有机物、O2为原料可设计成燃料电池。
(2)以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为______________________________________________________________________。
(3)以CH4、O2为原料,100 mL 0.15 mol/L NaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448 mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中溶质的成分及物质的量之比为____________________,各离子浓度由大到小的顺序为___________________。
III.利用I2O5消除CO污染的反应为:5CO(g) + I2O5(s) 5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答:
5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答:
(4)T2时,0 ~ 0.5 min内的反应速率v(CO) = ____________________。
(5)T1时化学平衡常数K = ____________________。
(6)下列说法不正确的是____________________(填字母序号)。
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的压强相等 |
| C.d点时,增大体系压强,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb < Kd |
环境中氮氧化物的合理控制和治理是减少雾霾天气、优化生存环境的有效途径之一。请运用化学反应原理知识,回答下列问题:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+ 4NO2 (g)="==" 4NO(g)+ CO2 (g)+ 2H2O(1) △H1 = -662kJ·mol-1
②CH4 (g)+ 4NO(g) ="==" 2N2 (g)+ CO2 (g)+ 2H2O(1) △H2 =" -1251" kJ·mol-1
据此,写出CH4将NO2还原为N2的热化学方程式:
(2)用活性炭还原法也可处理氮氧化物。有关反应为:C(s)+2NO(g)  N2 (g)+CO2 (g)
N2 (g)+CO2 (g)
某研究小组向一个容积(3L)恒定的真空密闭容器中加人0.3mol NO和足量的活性炭与催化剂(固体试样的体积忽略不计),在恒温(T1℃)条件下发生反应,经10min反应达到平衡,测得N2的物质的量为0.09mol。
①0min~10min内以v(NO)表示的平均化学反应速率为 。
②下列各项能判断该反应达到平衡状态的是 。
| A.容器内压强保持不变 |
| B.速率关系:2v(NO)(正) =" v" (N2)(逆) |
| C.容器内CO2的体积分数不变 |
| D.混合气体的密度保持不变 |
③在相同条件下,若在容器中放入生石灰,则NO的平衡转化率 (填“增大”、“不变”或“减小”)。
硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5 + OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L,15 ℃时测得:O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
| t/s |
0 |
120 |
180 |
240 |
330 |
530 |
600 |
700 |
800 |
| α/% |
0 |
33.0 |
41.8 |
48.8 |
58.0 |
69.0 |
70.4 |
71.0 |
71.0 |
回答下列问题:
(1)计算上述反应在120~180s与180~240s区间的平均反应速率
v1= 、v2= 。
比较两者大小可得到的结论是 。
(2)列式计算15 ℃时该反应的平衡常数K=_________________。(填数值)
(3)为提高反应物的平衡转化率,除适当控制反应温度外,另可采取的措施有 , (要求写出两条)。
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g) 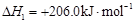
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2) = 。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。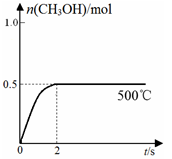
①反应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,
原因是 (用化学方程式表示)。
③在500℃恒压条件下,请在上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g)  ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 。 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
研究碳及其化合物有重要意义。
(1)科学家用CO2和H2生产甲醇做燃料。
已知:甲醇的燃烧热ΔH= -726.5kJ/mol;氢气的燃烧热ΔH= -285.8kJ/mol;
则常温常压下,CO2(g)和H2(g)反应生成CH3OH(l)的热化学方程式 。
(2)460℃时,在4L密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2和CH3OH(g)的物质的量随时间的变化关系如图所示。
①从反应开始到3min时,H2O(g)的平均反应速率 ,
②下列措施中既能加快反应速率又能使H2的转化率增大的是 ,
| A.使用更有效的催化剂 |
| B.在原容器中再充入1mol CO2 |
| C.在原容器中再充入1mol He |
| D.缩小容器的体积 |
E、将甲醇及时分离出来
③若该反应的焓变为ΔH,则下列示意图正确且能说明反应达到平衡状态的是________。
④该条件下,此反应的化学平衡常数为 。
(3)科学家研究发现,还可以用电催化法将CO2还原为碳氢化合物。原理如下图所示(电解质溶液是一种钾盐)。若CxHy为C2H4,则该原理的总反应式为为: 。
(4)已知
| 化学式 |
电离平衡常数 |
| HCN |
K=4.9×10-10 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)/c(CN-)=_________。
②向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:________________。
(10分)(1)恒温,容积为1 L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示(已知:2SO2(g)+O2(g)  2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题: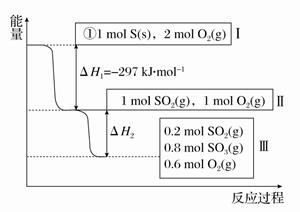
①写出能表示硫的燃烧热的热化学方程式: ___________________。
②ΔH2=________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①有效“减碳”的手段之一是节能,下列制氢方法最节能的是________(填序号)。
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O(g) 2H2+O2
2H2+O2
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O(g) CO+3H2
CO+3H2
②CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
③能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。
| 温度/℃ |
0 |
100 |
200 |
300 |
400 |
| 平衡常数 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应ΔS<0
C.在T℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 MPa)和250℃,是因为此条件下,原料气转化率最高
运用甲烷自热来制取氢气是目前较为先进的技术。其涉及的反应如下:
①CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H1=+165.0 kJ/mol 反应活化能Ea1="243.9" kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H2=-802.6 kJ/mol 反应活化能Ea2="125.6" kJ/mol
(1)2H2(g) + O2(g)= 2H2O(g)△H3= kJ/mol;
(2)下面能正确表示氢气和氧气反应生成水的能量变化示意图的是 (填字母序号)。
(3)运用甲烷自热来制取氢气是目前较为先进的技术。在同一反应系统同时通入甲烷、氧气和水蒸气,发生如上反应①和反应②,则反应开始时,反应①的反应速率 反应②的反应速率(填“>”、“<”或“=”),理由是 ;从能量角度分析,在该制氢过程中通入适量氧气发生反应②的目的是 ;
对于反应:CO(g)+H2O(g) 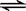 CO2(g)+H2 (g) ΔH>0请回答下列问题:
CO2(g)+H2 (g) ΔH>0请回答下列问题:
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如图,则 0~4min内的平均反应速率v(CO)=______ mol/(L·min)
(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
则:
①C1数值___(选填“>”、“<”或“=”)0.08 mol/L。
②反应在4min~5min间,平衡向逆反应方向移动,可能的原因是________(单选);表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度