BCl3是重要的化工原料,其沸点12℃。500℃时,向2L的密闭容器中按一定比例投入B2O3、C、Cl2,模拟工业制取三氯化硼的反应如下:B2O3(s) + 3C(s) + 3Cl2(g)  2BCl3 (g) + 3CO(g)。
2BCl3 (g) + 3CO(g)。
(1)反应起始至3min时固体质量减少了15.9克,则氯气的平均反应速率为_____________。
(2)反应至4min时达到平衡,则下列说法正确的是____________(填序号)。
A.3min时,CO的消耗速率大于氯气的消耗速率
B.2min至4min时BCl3的生成速率比0至2min时的快
C.反应起始至平衡,气体的密度不断增大
D.达到平衡后,容器内的压强不再变化
(3)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
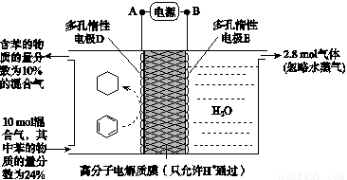
①A、D之间导线中电子移动方向为_______________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。
(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题。工业制硫酸的过程中,SO2催化氧化的原理:
2SO2(g)+O2(g)  2SO3(g) △H<0
2SO3(g) △H<0
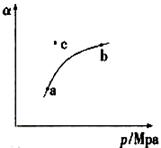
(1)某温度下,测得SO2(g)的平衡转化率(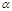 )与体系总压强( p )的关系如上图所示。a、b两点对应的平衡常数K(a) K(b) (填“>”“<”或“=”,下同)SO3浓度c(a) c(b)c点,反应速率υ(正) υ(逆)。
)与体系总压强( p )的关系如上图所示。a、b两点对应的平衡常数K(a) K(b) (填“>”“<”或“=”,下同)SO3浓度c(a) c(b)c点,反应速率υ(正) υ(逆)。
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行,反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
||
| SO2 |
O2 |
SO2 |
O2 |
||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为 ,温度T1大于T2的理由是 。
向2.0L恒容密闭容器中充入1.0mol PCl5,在温度为T时发生如下反应PCl5(g)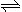 PCl3(g)+ Cl2(g)△H=" +124" kJ•mol-1。反应过程中测定的部分数据见下表:
PCl3(g)+ Cl2(g)△H=" +124" kJ•mol-1。反应过程中测定的部分数据见下表:

回答下列问题:
(1)反应在前50s的平均速率v(PCl5)= ,该反应的△S 0(填“<”、“>”或“=”).
(2)温度为T时,该反应的化学平衡常数= 。
(3)上述反应到达平衡状态时,PCl3的体积分数为 。
要提高平衡时PCl3的体积分数,可采取的措施有 。
| A.温度不变,压缩容器体积增大压强 | B.使用高效催化剂 |
| C.温度和体积不变,减小PCl5的起始量 | D.体积不变,提高反应温度 |
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a= 。
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是 。
在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)  CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则

(1) 0~4 min CO的平均反应速率v(CO)=___________mol/(L.min)。
(2)达平衡时CO的转化率为____________,T1℃时该反应的平衡常数K=_______________。
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
| 时间(min) |
CO |
H2O |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
C1 |
C2 |
C3 |
C3 |
| 4 |
C1 |
C2 |
C3 |
C3 |
| 5 |
0.116 |
0.216 |
0.084 |
C4 |
①表中3~4 min时,反应v正__________v逆(填“>”、“<”或“=”); C1___________0.08mol/L(填“>”、“<”或“=”)。
②4~5 min时,平衡向逆反应方向移动,可能的原因是__________(填字母)。
a.增加水蒸气 b.降低温度 c.增大了CO2浓度 d.增加了氢气浓度
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO 2(g)+O2(g) 2SO3(g);△H=-190KJ·mol-1
2SO3(g);△H=-190KJ·mol-1
(1)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO38g,则V(O2)= mol·L-1·min-1,计算此时化学平衡常数K1= 。
(2)若温度不变,继续通入0.20mol SO2和0.10mol SO3,则平衡移动方向及原因是 ,达平衡后,化学平衡常数为K2,则K1、K2之间的关系为 (填 “>”、“<”或“=”)。
(3)有两只密闭容器A和B,A能保持恒容,B能保持恒压。起始时向容积相等的A、B中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应。则(填>、=、<;左、右;增大、减小、不变)。
①达到平衡所需要的时间:t(A) t(B)
②平衡时,SO2的转化率:a(A) a(B)
③达到平衡时,在两容器中分别通入等量的Ar气。B中的化学平衡向 反应方向移动,A中的化学反应速率 。
(I)向一体积不变的密闭容器中充入2 mol A,0.6 mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g) 3C(g),各物质的浓度随时间变化的关系如图 1所示,其中t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况且t2,t3,t4各改变一种不同的条件。
3C(g),各物质的浓度随时间变化的关系如图 1所示,其中t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况且t2,t3,t4各改变一种不同的条件。
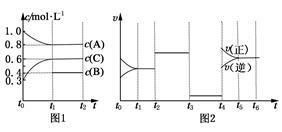
(1)若t1=15 min,则t0~t1阶段以C的浓度变化表示的反应速率v(C)=__________。
(2)t3时改变的条件为__________________,B的起始物质的量为__________________,
(3)t4~t5阶段,若A的物质的量减少了0.01 mol,而此阶段中反应体系吸收能量为a kJ,
写出此条件下该反应的热化学方程式:__________________。
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa |
2×105 |
5×105 |
1×106 |
| c(A)/mol·L-1 |
0.08 |
0.20 |
0.44 |
⑴当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
⑵维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol。
⑶当压强为1×106 Pa时,此反应的平衡常数表达式: 。
某科研人员设计出将硫酸渣(主要成分Fe2O3,含有少量的SiO2等杂质)再利用的流程。流程中的滤液经过多次循环后用来后续制备氧化铁粉末。
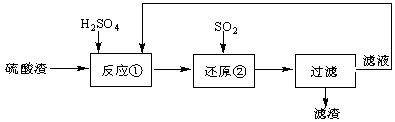
(1)为了加快反应①的反应速率,可采用的措施是 。(写出一点即可)
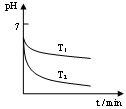
(2)“还原”是将Fe3+转化为Fe2+。在温度T1 、T2(T1 >T2)下进行该反应,通过检测相同时间内溶液的pH,绘制pH随时间的变化曲线如右图所示。得出结论:该反应的温度不宜过高。
①通入SO2气体“还原”时, 试解释pH下降的原因是 。
②相同时间内,T1温度下溶液的pH更高的原因是 。
(3)该流程中循环使用的物质是 。
(4)为测定反应①后溶液中Fe3+的浓度以控制加入SO2的量。实验步骤为:准确量取20.00ml的反应后溶液,稀释成100mL溶液,取10.00 mL溶液,加入足量的KI晶体和2~3滴淀粉溶液,用0.50mol/L的Na2S2O3溶液与碘反应,当反应恰好完全进行时,共消耗Na2S2O3溶液20.00 mL。有关反应方程式如下:2Fe3++2I-=2Fe2++I2; 2Na2S2O3 + I2= Na2S4O6 + 2NaI
试计算原溶液中Fe3+的物质的量浓度(写出计算过程)。
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_____ _____.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=﹣90.8kJ•mol﹣1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=﹣23.5kJ•mol﹣1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=﹣41.3kJ•mol﹣1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g) △H=___________;则该反应( )
| A.任何温度下都能进行 |
| B.任何温度下都不能进行 |
| C.高温下能自发进行 |
| D.低温下能自发进行 |
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(以上都填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol•L﹣1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正__________ v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=__________.
向2L密闭容器中加入0.15 mol·L-1A、0.05 mol·L-1C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0~t1时c(B)未画出,t1时增大到0.05 mol·L-1]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
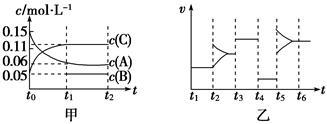
(1)若t4时改变的条件为减小压强,则B的起始物质的量为____________mol。
(2)若t5时改变的条件是升温,此时v(正)>v(逆),若A的物质的量减少0.03 mol时,容器与外界的热交换总量为a kJ,写出反应的热化学方程式:_______________________。
(3)t3时改变的某一反应条件可能是________(选填序号)。
A.t3时刻,增大了X的浓度 B.t3时刻,升高了体系温度
C.t3时刻,缩小了容器体积 D.t3时刻,使用了催化剂
(4)在恒温恒压下通入惰性气体,v(正)_________v(逆)(填“>”、“=”或“<”)。
(5)如图两个容器A、B中,A容器的容积保持不变,B容器保持和外界大气压一致。开始时,在保持两个容器体积相等的情况下,分别同时充入2moLH2S和1moLSO2。反应开始后两容器内反应平均反应速率A B (填“大于”、“小于”或“等于”)。
汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO+2CO 2CO2+N2.在密闭容器中发生该反应时c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
2CO2+N2.在密闭容器中发生该反应时c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
① T1_(填“>”“<”或“=”)T2。
② 在T2温度下,0~2s内的平均反应速率v(N2)=________。
(2)NO2、O2和熔融NaNO3可形成燃料电池,其原理如图所示。通入O2的一极为_______(填“正极”或“负极”),该电池在使用过程中石墨I电极上生成N2O5,其电极反应式为_________。
实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应:2A(g)+B(g) 2C(g);△H =QkJ/mol
2C(g);△H =QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
| 实验 序号 |
 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
8 0 0 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
8 0 0 ℃ |
n2 |
0.60 |
0. 50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
8 0 0 ℃ |
n3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
7 3 0 ℃ |
1.0 |
0.90 |
0.80 |
0.75 |
0.70 |
0.65 |
0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc= 实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q 0(填“>、=、<”),
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是

a.10~15 min可能是升高了温度
b.10~15 min可能是加入了催化剂
c.20 min时可能缩小了容器体积
d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA (g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的  。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的
。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的  。
。
①a、b、c必须满足的关系是 (一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是
某温度下,将2molA和3molB充入体积为2L的密闭容器中进行化学反应:A(g)+B(g) 2C(g) △H< 0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol。回答下列问题:
2C(g) △H< 0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol。回答下列问题:
(1)0~10s内A的平均反应速率为 。
(2)反应达平衡时B在平衡混合气体中的体积分数为 。
(3)平衡后,其他条件不变的情况下,将体积压缩到原来的1/2时,对反应产生的影响是 。
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正、逆反应速率都不变,平衡不移动,各物质物质的量不变
C.正、逆反应速率都增大,平衡不移动,B的物质的量浓度为1.8mol/L
D.正、逆反应速率都增大,平衡不移动,各物质的物质的量不变
(4)可以证明恒温恒容条件下该可逆反应已达到平衡状态的是 。
A.混合气体的密度不随时间而改变
B.混合气体的平均摩尔质量不随时间而改变
C.B和C在混合气体中的体积分数之比不随时间而改变
D.在隔热条件下,体系的温度不随时间而改变
(5)若在其他条件不变的情况下,采取下列措施反应达平衡C的百分含量不变的是 。
A.通入He气 B.使用催化剂
C.升高温度 D.再充入1molA和1.5molB
(6)若保持原温度和容器容积不变再向其中充入2molA和1molB,平衡常数将 (填“增大” “减小”或“不变”),整个过程中物质B的转化率为 。
(本小题满分14分)
T1温度下,体积为 2L的恒容密闭容器,加入4.00mol X,2.00mol Y,发生化学反应 2X(g)+Y(g) 3M(g)+N(s) △H<0。部分实验数据如表格所示。
3M(g)+N(s) △H<0。部分实验数据如表格所示。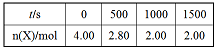
(1)前500s反应速率v(M)= _____________,该反应的平衡常数K=_____________。
(2)若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____________(填序号)
A.X的消耗速率与M的消耗速率相等
B.混合气体的平均相对分子质量不变
C.v(Y)与v(M)的比值不变
D.固体的总质量不变
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些_____________。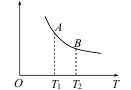
A.Y的逆反应速率
B.M的体积分数
C.混合气体的平均相对分子质量
D.X的质量分数
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____________。
A.平衡不移动
B.重新达平衡后,M的体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍
D.重新达平衡后,Y的平均反应速率与原平衡相等
E.重新达平衡后,用X表示的v(正)比原平衡大
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度_____________1.5mol/L(填“>”、“=”或“<”),理由是__________________。
自2013年3月我国北方地区出现了雾霾天气,其产生的原因说法不一,汽车的尾气排放被称为原因之一,有关氮的化合物的研究是一项重要课题。
(1).已知N2(g)+O2(g)=2NO(g) ΔH=+180.5KJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH= -566.0 KJ·mol-1
则加催化剂处理汽车尾气的热化学方程是
(2).反应2NO2(g)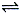 2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
| 时间(s) |
0 |
10 |
20 |
25 |
30 |
| 条件A [n(NO2)](mol) |
0.20 |
0.14 |
0.13 |
0.13 |
0.13 |
| 条件B [n(NO2)](mol) |
0.20 |
0.10 |
0.10 |
0.10 |
0.10 |
①条件A与条件B表示的是该反应在某不同条件的反应状况,该不同条件是
A.有、无催化剂 B.温度不同 C.压强不同 D.容器体积不同
②能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO) B.c(NO2)=c(NO) C.O2的物质的量不变
D.混合气体的密度不变 E.混合气体的平均摩尔质量
③在条件A从反应开始至10s时,氧气的平均速率为 mol·L-1·s-1
④在条件B不变保持压强不变的条件下,向平衡体系里再通入0.15molO2和0.1molNO2,则反应 (填“正向”、“逆向”或“不移动”)。
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=______________mol/(L·min)
CO2(g)+H2(g);△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=______________mol/(L·min)
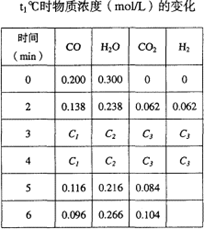
(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右上表。请回答:
①表中3min~4min之间反应处于____________状态;C1数值__________0.08mol/L(填大于、小于或等于)。
②反应在4min~5min问,平衡向逆方向移动,可能的原因是____________(单选),表中5min—6min之间数值发生变化,可能的原因是____________(单选)。
a、增加了水蒸气的量 b、降低温度 c、使用催化剂 d、增加氢气浓度