为探究外界条件对反应:mA(g)+nB(g) cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是
cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是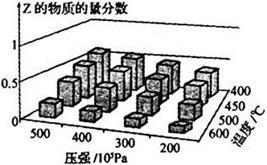
| A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数增大 |
| B.升高温度,正、逆反应速率都增大,平衡常数增大 |
| C.△H>0 m+n>c |
| D.温度不变,减小压强,平衡逆向移动,达新平衡时,A的浓度比原平衡减小 |
可逆反应mA(g)+nB(g)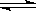 pC(g)+qD(g)的v-t图像如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。
pC(g)+qD(g)的v-t图像如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2⑥t1=t2
⑦两图中阴影部分面积相等 ⑧图乙中阴影部分面积更大
以上所述正确的为( )
| A.②④⑤⑦ | B.②④⑥⑧ | C.②③⑤⑦ | D.②③⑥⑧ |
炼铁的还原剂CO是由焦炭和CO2反应而得。现将焦炭和CO2放入体积为2 L的密闭容器中,高温下进行下列反应:C(s)+CO2(g) =2CO(g) ΔH=Q kJ·mol-1。下图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是
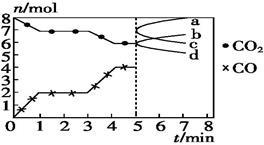
| A.0~1 min,v(CO)=1 mol·L-1·min-1;1~3 min,v(CO)=v(CO2) |
| B.当容器内的压强不变时,反应一定达到平衡状态,P(平衡) /P(起始) < 1 |
| C.3 min时,温度由T1升高到T2,则Q>0,再达平衡时,K(T2)/ K(T1)> 1 |
| D.5 min时再充入一定量的CO,a、b曲线分别表示n(CO)、n(CO2)的变化 |
下列有关化学反应原理的应用叙述中,正确的是
| A.用明矾净水是因为Al3+水解生成的Al(OH)3胶粒具有很强的吸附性 |
| B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| C.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 |
| D.工业合成氨使用催化剂是为了加快反应速率和提高氨的产量 |
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论不正确的是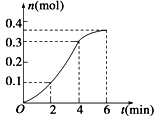
| A.反应开始2 min内平均反应速率最大 |
| B.反应速率先增大后减小 |
| C.反应2 min到第4 min内温度对反应速率的影响比浓度大 |
| D.反应在第2 min到第4 min内生成CO2的平均反应速率为前2 min的2倍 |
下列说法中正确的是( )
| A.Na2S2O3+2HCl==2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 |
B.若在恒容容器中发生反应:N2+3H2 2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 |
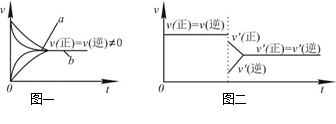
| C.在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率—时间图像可用图一表示 |
D.若在恒压容器中发生反应:2SO3 2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示 2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示 |
一定温度时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应:PCl5(g)⇌Cl2(g)
+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
下列说法正确的是
| A.反应在前50 s内的平均速率为v(PCl3)="0.0032" moI·L-l·s-l |
| B.保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11moI·L-l, 则正反应的△H<0 |
| C.相同温度下,若起始时向容器中充入1.0 molPCl5、0.20mol PCl3和0.20 mol Cl2,则反应达到平衡前v(正)<v(逆) |
| D.相同温度下,若起始时向容器中充入1.0mol PCl3、1.0 mol Cl2,则反应达到平衡时PCl3的转化率为80% |
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是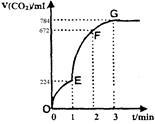
| A.OE段表示的平均速率最快 |
| B.EF段,用盐酸表示该反应的平均反应速率为0.6mol/(L·min) |
| C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7 |
| D.G点表示收集的CO2的量最多 |
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是
| A.2.5 μmol·L-1·min-1和2.0 μmol·L-1 |
| B.2.5 μmol·L-1·min-1和2.5 μmol·L-1 |
| C.3.0 μmol·L-1·min-1和3.0 μmol·L-1 |
| D.5.0 μmol·L-1·min-1和3.0 μmol·L-1 |
将4 mol A气体和2 mol B气体在 2 L容器中混合并在一定条件下发生如下反应:2A(g)+B(g)=" 2C" (g)若经2 s后测得C的浓度为0.6 mol•L-1,现有下列几种说法,其中正确的是
①用物质A表示的反应的平均速率为0.3 mol•L-1•S-1
②用物质B表示的反应的平均速率为0.6 mol•L-1•S-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol•L-1
| A.①③ | B.①④ | C.②③ | D.③④ |
在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol/L。在60 s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是
| A.前2 s,以N2O4浓度变化表示的平均反应速率为0.01 mol·L-1·s-1 |
| B.在2 s时,体系内压强为反应前的1.1倍 |
| C.平衡时,体系内含N2O4 0.25 mol |
| D.平衡时,若往容器内充入氮气,则可提高N2O4的转化率 |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是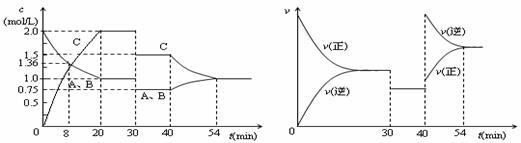
| A.第8min时 A的反应速率为0.08mol·L-1·min-1 |
| B.在0-54分钟的反应过程中该可逆反应的平衡常数始终为4 |
| C.30min时改变的条件是降低温度,40min时改变的条件是升高温度 |
| D.反应方程式中的x=1,且正反应为放热反应 |
一定条件下存在反应:C(s)+H2O(g)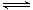 CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
| 容器 |
甲 |
乙 |
 丙 丙 |
| 容积 |
0.5 L |
0.5 L |
V |
| 温度 |
T1 ℃ |
T2 ℃ |
T1 ℃ |
| 起始量 |
2 molC1 molH2O |
1 molCO 1 molH2 |
4 molC 2 molH2O |
下列说法正确的是
A.甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B.丙容器的体积V < 0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)=0.4 mol,则T1 < T2
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3﹣+HSO3﹣→SO42﹣+Cl﹣+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3﹣在单位时间内物质的量浓度变化表示的该反应V﹣t图.下列说法中不正确的是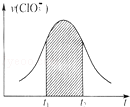
| A.反应开始时速率增大可能是c(H+)所致 |
| B.纵坐标为V(H+)的V﹣t曲线与图中曲线完全重合 |
| C.后期反应速率下降的主要原因是反应物浓度减小 |
| D.图中阴影部分“面积”可以表示t1﹣t2时间为c(Cl﹣)增加 |