向2.0L恒容密闭容器中充入1.0mol PCl5,在温度为T时发生如下反应PCl5(g) PCl3(g)+ Cl2(g)△H=" +124" kJ•mol-1。反应过程中测定的部分数据见下表:
PCl3(g)+ Cl2(g)△H=" +124" kJ•mol-1。反应过程中测定的部分数据见下表:

回答下列问题:
(1)反应在前50s的平均速率v(PCl5)= ,该反应的△S 0(填“<”、“>”或“=”).
(2)温度为T时,该反应的化学平衡常数= 。
(3)上述反应到达平衡状态时,PCl3的体积分数为 。
要提高平衡时PCl3的体积分数,可采取的措施有 。
| A.温度不变,压缩容器体积增大压强 | B.使用高效催化剂 |
| C.温度和体积不变,减小PCl5的起始量 | D.体积不变,提高反应温度 |
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a= 。
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是 。
相关知识点
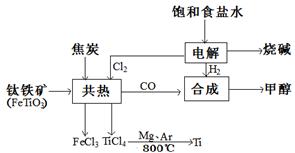
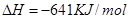
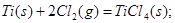
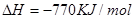
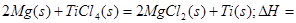 ____________
____________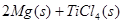
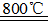
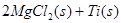 在Ar气氛中进行的理由是________
在Ar气氛中进行的理由是________ C(s)=
C(s)= 2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为mol/(L·h).
2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为mol/(L·h). Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.
Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.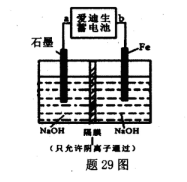
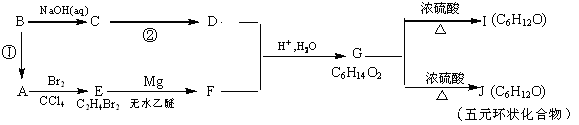
 RCH2OH, RX
RCH2OH, RX RCOOH.有机化合物A可发生如题28-1图转化关系(无机产物略去),其中G与FeC13溶液能发生显色反应,且环上的一元取代产物只有两种结构.
RCOOH.有机化合物A可发生如题28-1图转化关系(无机产物略去),其中G与FeC13溶液能发生显色反应,且环上的一元取代产物只有两种结构.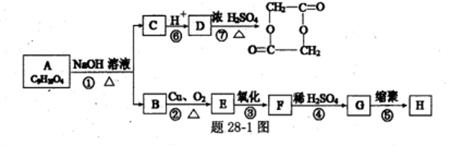
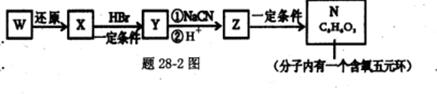
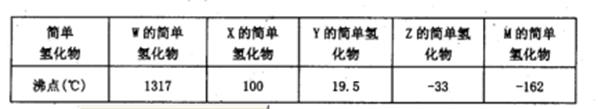
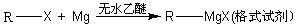

 粤公网安备 44130202000953号
粤公网安备 44130202000953号