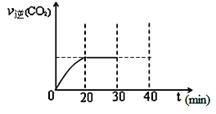
500℃时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,分析图像完成下列问题:
(1)0~10分钟,N2的平均反应速率为________mol·L-1·min-1,0~10分钟与10~20分钟两个时间段中,N2的反应速率之比为________。反应在第10 min可能改变的条件是________,运用图像信息说明该条件不是升温的原因:________。
(2)计算500℃时,反应N2+3H2 2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
(3)在上图中画出25~40 min时间段内N2的物质的量的变化图像。
(创新预测题)(1)在100 ℃恒温条件下将0.100 mol的N2O4充入体积为1 L的真空密闭容器中,发生反应:N2O4(g) 2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
| t/s c/(mol·L-1) |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4)/(mol·L-1) |
0.100 |
a |
0.5b |
0.4b |
|
|
| c(NO2)/(mol·L-1) |
0 |
0.060 |
b |
c1 |
c2 |
c3 |
请回答下列问题:
①表中a=______,在0~20 s内N2O4的平均反应速率为_______mol·(L·s)-1。
②已知100 ℃时该反应的平衡常数为0.36,则表中b、c1、c2的大小关系为________,c3=________mol·L-1,达到平衡时N2O4的转化率为_________________。
(2)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H4SiO4溶液,反应原理如下:
SiO2(s)+2H2O(l) H4SiO4(aq) ΔH
H4SiO4(aq) ΔH
①写出该反应的化学平衡常数K的表达式:________________________________。
②实际上,在地球的深处,由于压强很大,固体、液体都会受到影响。在一定温度下,在10 000 m以下的地球深处,上述反应的方向是________(填“正方向”、“逆方向”或“不移动”),理由是______________________________________。
(1)已知:O2 (g)= O2+ (g)+e- △H1=" +1175.7" kJ·mol-1
PtF6(g)+ e-= PtF6-(g) △H2=" -" 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- (g) △H3="+482.2" kJ·mol-1
则反应:O2(g)+ PtF6 (g) = O2+PtF6(s)的△H="_____" kJ·mol-1。
如图为合成氨反应在使用相同的催化剂,不同温度和压强条件下进行反 应,初始时N2和H2的体积比为1:3时的平衡混合物中氨的体积分数:
① 在一定的温度下,向体积不变的密闭容器中充入氮气和氢气发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系的压强保持不变 b.混合气体的密度保持不变
c.N2和H2的体积比为1:3 d.混合气体的平均摩尔质量不变
②分别用vA(NH3)和vB(NH3)表示从反应开始到平衡状态A、B时的反应速率,则vA(NH3) vB(NH3)(填“>”、“<”或“=”),该反应的的平衡常数kA kB(填“>”、“<”或“=”),在250 ℃、1.0×104kPa下达到平衡,H2的转化率为 %(计算结果保留小数点后一位);
(3)25℃时,将a mol NH4NO3溶于水,溶液呈酸性,原因 (用离子方程式表示)。向该溶液中加入bL氨水后溶液呈中性,则所加氨水的浓度为 mol/L(用含a、b的代数式表示,NH3·H2O的电离平衡常数为Kb=2×10-5)
(4)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。电镀一段时间后,装置Ⅰ中溶液的pH (填“变大”、“变小”或“不变”),a极电极反应方程式为 ;若电镀结束后,发现装置Ⅱ中阴极质量变化了25.6g(溶液中硫酸铜有剩余),则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。
(I)在一定条件下,发生反应:aA(g)+bB(g) cC(g)△H="Q" kJ/mol,其化学平衡常数K和温度的关系如下表所示:
cC(g)△H="Q" kJ/mol,其化学平衡常数K和温度的关系如下表所示:
依据图表判断该反应△H 0(填“>”或“<”):若其它条件保持一定,降低温度,该反应物A的转化率 (填“增大”、“减小”或“不变”下同),化学反应速率将 。
 (II)在恒定温度t℃,2L恒容密闭容器中发生反应aA(g)+bB(g) cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
(II)在恒定温度t℃,2L恒容密闭容器中发生反应aA(g)+bB(g) cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
(1)该化学方程式中a:b:c为 ,t℃时该反应的化学平衡常数K的值为____ 。(保留2位小数)
(2)0~15 min内,B的平均反应速率为 ,反应达平衡时,A的转化率为 。
(3)据图判断,反应进行至20 min时,曲线发生变化的原因是 (用文字表达),反应重新达平衡时,A的体积分数将 (填“增大”、“减小”或“不变”)。
(4)10 min到15 min的曲线变化的原因可能是 。
随着大气污染的日趋严重,国家拟于“十二”五期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) ="4NO(g)" + CO2(g) +2H2O(g) ⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g) ⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) △H=" -44.0" kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
浓度/mol·L-1
时间/min |
NO |
N2 |
CO2 |
||
| 0 |
1.00 |
0 |
0 |
||
| 10 |
0.58 |
0.21 |
0.21 |
||
| 20 |
0.40 |
0.30 |
0.30 |
||
| 30 |
0.40 |
0.30 |
0.30 |
||
| 40 |
0.32 |
0.34 |
0.17 |
||
| 50 |
0.32 |
0.34 |
0.17 |
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①10min~20min以v(CO2) 表示的平均反应速率为 。
②根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变
B.2v正(NO) = v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是 。请在图中画出30min至40min的变化曲线。
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)ΔH1
②IO-(aq)+H+(g)=HOI(aq)ΔH2
③HOI(aq)+I-(aq)+H+(aq)=I2(aq)+H2O(l)ΔH3
总反应的化学方程式为_________________________________,
其反应热ΔH=______________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)  I3-(aq),其平衡常数表达式为________。
I3-(aq),其平衡常数表达式为________。
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3-浓度和体系pH,结果见图2和下表。
| 编号 |
反应物 |
反应前pH |
反应前pH |
| 第1组 |
O3+I- |
5.2 |
11.0 |
| 第2组 |
O3+I-+Fe2+ |
5.2 |
4.1 |
①第1组实验中,导致反应后pH升高的原因是______________。
②图1中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是____________________。
③第2组实验进行18 s后,I3-浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小
B.c(I-)减小
C.I2(g)不断生成
D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
(1)N2(g)+3H2(g)  2NH3(g) ΔH=-94.4 kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图所示。
2NH3(g) ΔH=-94.4 kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图所示。
①在1 L容器中发生反应,前20 min内,v(NH3)=________,放出的热量为________。
②25 min时采取的措施是_______________________;
③时段Ⅲ条件下反应的平衡常数表达式为________(用具体数据表示)。
(2)电厂烟气脱离氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO (g)
5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO (g)  5N2O(g)+3H2O(g) ΔH>0。测得平衡混合气中N2和N2O含量与温度的关系如图。在400~600 K时,平衡混合气中N2含量随温度的变化规律是________,导致这种变化规律的原因是________(任答合理的一条原因)。
5N2O(g)+3H2O(g) ΔH>0。测得平衡混合气中N2和N2O含量与温度的关系如图。在400~600 K时,平衡混合气中N2含量随温度的变化规律是________,导致这种变化规律的原因是________(任答合理的一条原因)。
(3)直接供氨式燃料电池是以NaOH溶液为电解质的。电池反应为4NH3+3O2=2N2+6H2O,则负极电极反应式为________。
工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)  2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
| NH3 |
0 |
0.20 |
|
1.00 |
1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
据此判断:
①该反应的ΔH________0(填“>”或“<”)
②在T2温度下,0~2 s内的平均反应速率v(N2)=______________________。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填代号)。

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH1=-867 kJ/mol
2NO2(g)N2O4(g) ΔH2=-56.9 kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式:________________________________________________________________________。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的
目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为__________________________。
③常温下,0.1 mol·L-1的HCOONa溶液pH为10,则HCOOH的电离常数Ka=________。
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)===IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq) HOI(aq) ΔH2
HOI(aq) ΔH2
③HOI(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
总反应的化学方程式为_________________________________,其反应热ΔH=________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3—(aq),其平衡常数表达式为________。
I3—(aq),其平衡常数表达式为________。
(3) 为探究Fe2+对O3氧化I-反应的影响(反应体系如上图),某研究小组测定两组实验中I3—浓度和体系pH,结果见下图和下表。
| 编号 |
反应物 |
反应前pH |
反应后pH |
| 第1组 |
O3+I- |
5.2 |
11.0 |
| 第2组 |
O3+I-+Fe2+ |
5.2 |
4.1 |

图2
①第1组实验中,导致反应后pH升高的原因是_____________________________
②图1中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是_____________________________________________
③第2组实验进行18 s后,I3—浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3—的平均反应速率(写出计算过程,结果保留两位有效数字)。
一定温度下,在一个10 L密闭容器中发生某可逆反应,其平衡常数表达式为K= 。请回答下列问题。
。请回答下列问题。
(1)该反应的化学方程式为__________________________________________;
若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
| A.v正(H2O)=v逆(H2) |
| B.容器中气体的平均相对分子质量不随时间改变 |
| C.消耗n mol H2的同时消耗n mol CO |
| D.容器中物质的总物质的量不随时间改变 |
(3)该反应的v正随时间变化的关系如图,在t2时改变了某种条件,改变的条件可能是________、________。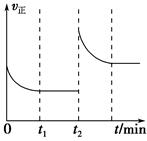
(4)实验测得t2时刻容器内有1 mol H2O(g),5 min后H2O(g)的物质的量是0.8 mol,这5 min内H2O(g)的平均反应速率为________。
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
已知COCl2(g)Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
(1)化学平衡常数表达式K=________,计算反应在第8 min时的平衡常数K=________;
(2)比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
(3)若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________;10~12 min内CO的平均反应速率为v(CO)=________;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率(平均反应速率分别以v(2~3)、v(5~6)、v(12~13))的大小________________。
向2.0L恒容密闭容器中充人1.0mol PCl5,在温度为T时发生如下反应
PCl5(g)  PCl3(g)+C12(g)
PCl3(g)+C12(g)  H=124kJ·mol-1。反应过程中测定的部分数据见下表:
H=124kJ·mol-1。反应过程中测定的部分数据见下表:
| 时间t/s |
0 |
50 |
150 |
250 |
350 |
| n(PCL3)/mol |
0 |
0.16 |
0.19 |
0.2 |
0.2 |
回答下列问题
(1)反应在前50 s的平均速率v(PCI5)=________。
(2)温度为T时,该反应的化学平衡常数=________。
(3)要提高上述反应的转化率,可采取的措施有________。
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=________。
(5)在热水中,五氯化磷完全水解,生成磷酸(H3 PO4),该反应的化学方程式是________。
若将0.01 mol PCI5投入l L热水中,再逐滴加入AgNO3溶液,先产生的沉淀是________ [已知Ksp(Ag3 PO4)="1.4" x 1 0-16,Ksp(AgCl)="1.8" x 10-10]。
(6)一定条件下,白磷溶于硝酸溶液产生一种氮氧化合物气体,该气体与白磷的物质的量之比为20:3,反应的化学方程式为____________________________。
回答以下关于第三周期元素及其化合物的问题。
(1)下列能用于判断氧和氟非金属性强弱的是 (选填编号)。
A.气态氢化物的稳定性 B.最高价氧化物对应水化物的酸性
C.单质与氢气反应的难易 D.单质与同浓度酸发生反应的快慢
(2)Be和Al具有相似的化学性质,写出BeCl2水解反应的化学方程式
(3)常温下,不能与铝单质发生反应的是_________(填序号)
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH E.Na2CO3固体
(4)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 |
NaF |
MgF2 |
SiF4 |
| 熔点/℃ |
1266 |
1534 |
183 |
试解释上表中氟化物熔点差异的原因: 。SiF4分子的空间构型为 ,SiF4中Si—F键间的键角 。(选填“相等”、“不相等”或“无法判断”)
(5)Cl2合成有机物时会产生副产物HC1。4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
该反应平衡常数的表达式K= ;若反应容器的容积为2L,8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 mol/L∙ min。