(14分,除标明外,每空2分)在实验室进行工业合成氨的模拟实验:
N2(g) + 3H2(g) 2NH3(g) △H<0。当反应达到平衡后,分离出氨,并按与起始时原料气相同的物质的量之比补充N2、H2,以实现连续生产,各组分物质的量和时间的关系如图所示(容器体积为1 L,各平衡状态时N2物质的量均可视为0.9mol)。
2NH3(g) △H<0。当反应达到平衡后,分离出氨,并按与起始时原料气相同的物质的量之比补充N2、H2,以实现连续生产,各组分物质的量和时间的关系如图所示(容器体积为1 L,各平衡状态时N2物质的量均可视为0.9mol)。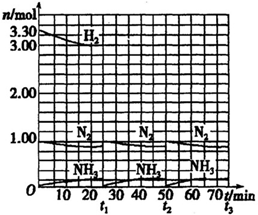
(1)①以NH3的浓度变化表示反应开始至15 min时该反应的平均速率是 (保留三位有效数字)。
②I阶段15 min达到平衡,则I阶段的平衡常数为 ;Ⅱ阶段,达到平衡状态时,代表氢气的曲线上的点的坐标为( )。
③H2在I、Ⅱ的平衡转化率aI(H2)、aⅡ(H2)中较小的是 ,其值是 (保留三位有效数字)。
(2)在甲、乙两容器中分别进行反应N2(g) + 3H2 2NH3(g),甲容器容积固定,乙容器容积可变。一定温度下,在甲中充入amol N2、b mol H2(3a>b=3),达到平衡时NH3的物质的量为cmol。
2NH3(g),甲容器容积固定,乙容器容积可变。一定温度下,在甲中充入amol N2、b mol H2(3a>b=3),达到平衡时NH3的物质的量为cmol。
①相同温度下,在乙中加入2a mol N2、2b mol H2,若乙的压强始终与甲的压强相等,乙中反应达到平衡时NH3的物质的量为 mol(填字母序号,下同);若乙的容积与甲的容积始终相等,乙中反应达到平衡时NH3的物质的量为 mol。
| A.大于2c | B.等于2c | C.在c~2c之间 | D.等于c E.小于c |
②相同温度下,保持乙的容积为甲的一半,并加入1mo1NH3,要使乙中反皮达到平衡时,各物质的体积分数与上述甲容器中达到平衡时的相同,则起始时还应加入 和 (用含a、b的代数式表示)。
相关知识点
 (4)用如上图所示的实验装置可精制粗溴。
(4)用如上图所示的实验装置可精制粗溴。



 粤公网安备 44130202000953号
粤公网安备 44130202000953号